| Платина | |
| Атомный номер | 78 |
| Внешний вид простого вещества | Тяжёлый мягкий серебристо-белый металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 195,08 а. е. м. (/моль) |
| Радиус атома | 139 |
| Энергия ионизации (первый электрон) | 868,1(9,00) кДж/моль () |
| Электронная конфигурация | [Xe] 4f14 5d9 6s1 |
| Химические свойства | |
| Ковалентный радиус | 130 |
| Радиус иона | (+4e) 65 (+2e) 80 |
| Электроотрицательность (по Полингу) | 2,28 |
| Электродный потенциал | Pt←Pt2+ 1,20В |
| Степени окисления | 4, 2, 0 |
| Термодинамические свойства простого вещества | |
| Плотность | 21,45 /³ |
| Молярная теплоёмкость | 25,85[1]/(·моль) |
| Теплопроводность | 71,6 /(·) |
| Температура плавления | 2045 |
| Теплота плавления | 21,76 кДж/моль |
| Температура кипения | 4100 |
| Теплота испарения | ~470 кДж/моль |
| Молярный объём | 9,10 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,920 |
| Отношение c/a | n/a |
| Температура Дебая | 230,00 |
| Pt | 78 |
| 195,08 | |
| 4f145d96s1 | |
| Платина | |
Платина — 78 элемент периодической таблицы, атомная масса 195,08; благородный металл серо-стального цвета. В Старом Свете платина не была известна, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. В Европе платина была неизвестна до XVIII века.
В 1735 году испанский король издаёт указ, повелевающей платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять её от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель-Пинто, которую стали именовать Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. В 1748 году испанский математик и мореплаватель А. де Ульоа первым привез на европейский континент образцы самородной платины, найденной в Перу. Впервые в чистом виде из руд платина была получена английским химиком У. Волластоном в 1803 году итальянский химик Джилиус Скалигер в 1835 году открыл неразложимость платины и таким образом доказал, что она является независимым химическим элементом. В России еще в 1819 году в россыпном золоте, добытом на Урале был обнаружен «новый сибирский металл». Сначала его называли белым золотом, платина встречалась на Верх-Исетских, а затем и на Невьянских и Билимбаевских приисках. Богатые россыпи платины были открыты во второй половине 1824 года, а на следующий год в России началась ее добыча.
Происхождение названия
Название платине было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в Южной Америке (на территории современной Колумбии) с новым металлом, внешне похожим на серебро (plata
). Слово исп.
Platina
буквально означает «маленькое серебро», «серебришко» (платина против серебра стоила вдвое дешевле). Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро.
Кристаллическая решётка платины:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 3,920 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 230 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Получение
Самородную платину добывают на приисках (см. подробнее в статье Благородные металлы)
Производство платины в виде порошка началось в 1805 английским ученым У. Х. Волластоном из южноамериканской руды. Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют (NH4)2PtCl6. Высушенный осадок прокаливают при 800-1000°C: (NH4)2PtCl6 = N2 + 6HCl + Pt + H2. Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении платиновых растворов химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Химические свойства
По химическим свойствам платина похожа на палладий, но проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой: 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов): Pt + 2Cl2 + 2NaCl = Na2[PtCl6]. При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объем поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: черный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и Pt3O4.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлорплатинатов, например: Na2PtCl4 + 2NaOH = 4NaCl + Pt(OH)2I, Na2PtCl6 + 4NaOH = 6NaCl + Pt(OH)4I. Эти гидроксиды проявляют амфотерные свойства: Pt(OH)2 + 2NaOH = Na2[Pt(OH)4], Pt(OH)2 +4HCl = H2[PtCl4] + 2H2O, Pt(OH)4 + 6HCl = H2[PtCl6] + 4H2O, Pt(OH)4 + 2NaOH = Na2[Pt(OH)6]. Гексафторид PtF6 — один из сильнейших окислителей, способный окислить молекулы кислорода, ксенона или NO: O2 + PtF6 = O2+[PtF6]-.
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию XePtF6, началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением. Фторирование платины при нормальным давлении и температуре 350—400 °C даёт фторид Pt(IV): Pt + 2F2 = PtF4 Фториды платины гигроскопичны и разлагаются водой. Тетрахлорид платины (IV) с водой образует гидраты PtCl4·nH2O, где n = 1, 4, 5 и 7. Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6]. Синтезированы такие галогениды платины как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2. Для платины характерно образование комплексных соединений состава [PtX4]2— и [PtX6]2-. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Реакционная способность
Монета 3 рубля, 1834
Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее охотно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
В своих соединениях платина проявляет почти все степени окисления от 0 до +8, из которых наиболее устойчивы +2 и +4. Для платины характерно образование многочисленных комплексных соединений, которых известно много сотен. Многие из них носят имена изучавших их химиков (соли Косса, Магнуса, Пейроне, Цейзе, Чугаева и т. д.). Большой вклад в изучение таких соединений внес русский химик Л. А. Чугаев (1873−1922), первый директор созданного в 1918 году Института по изучению платины.
Гексафторид платины PtF6 является одним из сильнейших окислителей среди всех известных химических соединений. С помощью него, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона XePtF6.
Катализатор
Платина, особенно в мелкодисперсном состоянии, является очень активным катализатором многих химических реакций, в том числе используемых в промышленных масштабах. Например, платина катализирует реакцию присоединения водорода к ароматическим соединениям даже при комнатной температуре и атмосферном давлении водорода. Еще в 1821 немецкий химик И. В.Дёберейнер обнаружил, что платиновая чернь способствует протеканию ряда химических реакций; при этом сама платина не претерпевала изменений. Так, платиновая чернь окисляла пары винного спирта до уксусной кислоты уже при обычной температуре. Через два года Дёберейнер открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идет сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, платиновая губка раскаляется, и гремучий газ взрывается. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек.
Производство
До 1748 г. платина добывалась и производилась только на территории Америки и в Старом Свете не была известна.
Когда платину стали завозить в Европу её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше чем у золота, то незначительные добавки серебра позволила изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Этот закон просуществовал до 1778 года. После отмены закона потребность в платине была небольшой, её использовали в основном для создания химического оборудования, приспособлений и в качестве катализаторов. Добываемой в Америке платины для этих целей было достаточно. Ни о каком значимом промышленном производстве говорить не приходится.
В 1819 году платину впервые обнаружили на Урале близ Екатеринбурга, а в 1824 г. были открыты платиновые россыпи в Нижнетагильском округе. Разведанные запасы платины были столь велики, что Россия почти сразу заняла первое место в мире по добыче этого метала. Только в 1828 году в России было добыто 1,5 т платины — больше, чем за 100 лет в Южной Америке. К концу XIX века в России добывалось платины в 40 раз больше чем во всех остальных странах мира. Причем, представлена она была и весьма увесистыми самородками. Например, один из найденных на Урале самородков весил 9,6 кг.
К середине XIX в. в Англии и Франции были проведены обширные исследования по аффинажу платины. В 1859 году французский химик Анри Этьен Сент-Клер Девиль впервые разработал промышленный способ получения слитков чистой платины. С этого времени, почти вся добываемая на Урале платина скупалась английскими и французскими фирмами, в частности, «Джонсон, Маттей и К°». Позже к закупкам платины у России подключились американские и немецкие компании.
Даже после значительных зарубежных закупок, большая часть добываемой Россией платины не находила достойного применения. Поэтому, начиная с 1828 года, по предложения министра финансов Егора Канкрина, в России начали выпускать платиновые монеты номиналом 3,6 и 12 рублей. При этом, 12-рублевая платиновая монета имела массу 41,41 г, а в рублевой серебряной монете было 18 г чистого серебра. То есть по стоимости металла платиновые монеты были дороже серебряных в 5,2 раза. С 1828 по 1845 гг. было выпушено 1 372 000 трехрублевых монет, 17 582 шестирублевых и 3 303 двенадцатирублевых общей массой 14,7 т. Основную выгоду от добычи получали владельцы рудников — Демидовы. Оцените, — только в 1840 было добыто 3,4 т платины. В 1845 году, по настоянию министра финансов Фёдора Вронченко выпуск платиновых монет был прекращён и все они были срочно изъяты из обращения. Основной версией столь поспешного шага считается повышение европейских цен на платину, в результате которого монеты стали дороже номинала. После прекращения чеканки монет производство платины в России упало в 20 раз и к 1915 году на долю России приходилось лишь 95 % от мирового производства платины. Оставшиеся 5 % производила Колумбия. Причем, почти вся российская платина поступала на экспорт. Например, в 1867 году Англия скупила весь запас российской платины — более 16 т.
К концу XIX в. Россия производила 4,5 т. платины в год.
До Первой мировой войны второй после России страной по объемам добычи платины была Колумбия; с 1930-х гг. стала Канада, а после Второй мировой войны — Южная Африка.
В 1952 году Колумбия добыла 0,75 т платины, США — 0,88 т, в Канада — 3,75 т, а Южно-Африканский Союз — 7,2 т. В СССР данные по добыче платины были засекречены.
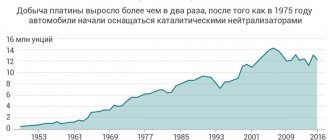
В 2007 году в мире было добыто 213 т платины, а в 2008 году — 200 т. Лидерами добычи были: ЮАР (в 2007 году добыто 166,0 т, а в 2008 году — 153,0 т), Россия (27,0/25,0), Канада (6,2/7,2), Зимбабве (5,3/5,6), США (3,9/3,7), Колумбия (1,4/1,7).[3]
Лидером добычи платины в России является ГМК «Норильский никель».
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между Южной Африкой (87,5 %), Россией (8,3 %) и США (2,5 %).
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 42\7 электронов.
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Применение
В технике
- С первой четверти XIX века применялась в России в качестве легирующей добавки для производства высокопрочных сталей[4]
- Платина применяется как катализатор (чаще всего в сплаве с родием, а также в виде платиновой черни
— тонкого порошка платины, получаемой восстановлением ее соединений). - Платина применяется в ювелирном и зубоврачебном деле, а также в медицине.
- Изготовление стойкой химически и к нагреванию лабораторной посуды.
- Изготовление миниатюрных магнитов огромной силы (сплав платина-кобальт, ПлК-78).
- Специальные зеркала для лазерной техники.
- Чрезвычайно долговечные и стабильные электроконтакты и сплавы для радиотехники (ПлИ-10, ПлИ-20, ПлИ-30 (платина-иридий).
- Гальванические покрытия.
- Перегонные реторты для производства плавиковой кислоты.
- Электроды для получения перхлоратов, перборатов, перкарбонатов, пероксодвусерной кислоты (фактически на платине держится все мировое производство перекиси водорода: электролиз серной кислоты — пероксодвусерная кислота — гидролиз — отгонка перекиси водорода).
- Нерастворимые аноды в гальванотехнике.
- Анодные штанги для защиты от коррозии корпусов подводных лодок.
- Нагревательные элементы печей сопротивления.
В медицине
Соединения платины (преимущественно, тетрахлорплатинаты) применяются, как цитостатики («цис-платина»). Однако в настоящее время имеются более эффективные противораковые лекарственные средства.
В ювелирном деле
Платина и её сплавы широко используются для производства ювелирных изделий.
Ежегодно мировая ювелирная промышленность потребляет около 50 тонн платины. До 2001 года большая часть ювелирных изделий из платины потреблялась в Японии. С 2001 года на долю Китая приходится примерно 50 % мировых продаж. В 1980 г. Китай потреблял около 1 % ювелирных изделий из платины. В настоящее время в Китае ежегодно продаётся около 10 млн изделий из платины общей массой около 25 тонн.
Российский спрос на ювелирную платину составляет 0,1 % от мирового уровня.
Монетарная функция
Основная статья
:
Платиновые монеты
Платиновая монета 1835 года номиналом 12 рублей.
Платина, золото и серебро — основные металлы, выполняющие монетарную функцию. Однако платину стали использовать для изготовления монет на несколько тысячелетий позже золота и серебра.
Первые в мире платиновые монеты были выпущены и находились в обращении в Российской империи с 1828 по 1845 год. Чеканка началась с трехрублевиков. В 1829 г. «были учреждены платиновые дуплоны» (шестирублевики), а в 1830 г.— «квадрупли» (двенадцати-рублевики). Были отчеканены следующие номиналы монет: достоинством 3, 6 и 12 рублей. Трехрублевиков было отчеканено 1 371 691 шт., шестирубле-виков — 14 847 шт. и двенадцатирублевиков — 3474 шт.[2]
В 1846 г. чеканка платиновой монеты была прекращена, хотя к этому году добыча уральской платины составила около 2000 пудов или 32 000 кг, из которых в монету было перечеканено 14 669 кг. Громадной количество платины, скопившейся на Петербургском монетном дворе частью в виде монеты, а частью в необработанном виде (по разным данным от 720 до 2000 пудов), было продано английской фирме Джонсон, Маттэ и Ко. В результате Англия, которая не добывала ни одного грамма платины, долго была в этой отрасли монополистом.[5]
После 1846 года ни одна страна не позволяла себе «роскоши» вводить в обращение платиновые монеты. Выпускаемые разными странами в настоящее время платиновые монеты являются инвестиционными монетами. В период с 1992 по 1995 год инвестиционные платиновые монеты номиналами 25, 50 и 150 рублей выпускал Банк России.
Как определить подлинность
Под видом платины предлагают серебро либо белое золото.
Можно определить подлинность изделия в домашних условиях:
- Изделие из платины тяжелее золотого, тем более серебряного сопоставимых параметров.
- Положить рядом изделие из серебра и образец. Даже высокопробное серебро выдает сероватость и «холодность». Платиновый состав отличает чистый теплый белый блеск.
Есть и другие отличия платины от белого золота:
- Платиновые кольца, серьги, даже колье и браслеты не бывают крупногабаритными, массивными – металл слишком дорог.
- При обычной температуре на нее не действуют перекись водорода, раствор йода, уксусная кислота. На поверхности они не оставят следов.
- Под пламенем свечи, зажигалки, бытовой газовой плиты она нагреется, но не изменится внешне. Золото может размягчиться.
- Можно подержать образец в руках: царский металл нагревается дольше золота, тем более серебра.
- Гарантированно отличить оригинал способен работник ломбарда или ювелир.
Платина выглядит почти как белое золото, поэтому многие уверены, что это одно и то же. Однако белое золото – это сплав металлов, а платина – самостоятельный элемент.
Интересные факты
- Самым крупным существующим в настоящий момент платиновым самородком является «Уральский гигант» весом 7 860,5 . Хранится в Алмазном фонде Московского Кремля.
- В Южной Америке в XVII веке платину считали «поддельным серебром» и однажды её запасы для предотвращения фальшивомонетничества утопили в океане.
- Первые в мире монеты из платины были выпущены в России (см. Платиновые монеты).
- В цикле рассказов Айзека Азимова «Я, робот» и других его произведениях позитронный мозг роботов сделан из губчатой платины (точнее — сплава платины и иридия).
Как хранить и ухаживать
Чтобы изделия из платины сохраняли изначальные премиальные кондиции, достаточно простого ухода:
- Украшения (особенно кольца и браслеты) снимают перед домашними работами (стирка, уборка, готовка).
- Их ограждают от влаги, бытовой химии, особенно агрессивной.
- Хранить нужно в отдельной, плотно закрываемой шкатулке.
Потускнение или загрязнение удаляют, погрузив изделие в теплый мыльный раствор на пару часов. Затем ополаскивают водой, просушивают мягкой салфеткой.
По возможности приобретают средство для чистки платиновых изделий.
Если украшение с бриллиантами или другими камнями, его отдают на профессиональную чистку.