Здравствуйте, дорогие наши читатели! Вы когда-нибудь задумывались, алмаз и графит — что может быть у них общего? Казалось бы, алмаз – это то, из чего делают дорогие украшения, радующие глаз человека даже с самым утонченным вкусом. Твердый, жесткий и практически неразрушимый. И графит – основной элемент для изготовления карандашей, очень хрупкий и легко ломается. Вспомните, как часто у вас ломался грифель?
Тем не менее, оба минерала являются родственными друг другу. Более того, воссоздание специальных условий позволяет осуществить процесс превращения из графита в алмаз, так и наоборот.
Прочтение статьи позволит вам узнать какими свойствами обладают представленные в статье минералы, о том, как они вообще появились на Земле, куда нужно отправиться для того, чтобы добывать алмазы. Или, если повезет меньше, графит, а также, возможно ли изготовление алмазов и графита в домашних условиях.
Желаем приятного прочтения!
Свойства алмаза и графита
Коротко об аллотропном углероде и карбине. В периодической таблице Менделеева этот тип неметалла расположен под номером 6. Валентное состояние углерода коренным образом влияет на свойства вещества, в котором он присутствует.
Несмотря на то, что алмаз от графита отличается по всем характеристикам, оба минерала построены из свободного углерода.
Химические свойства
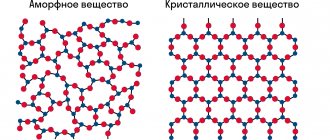
Структура кристалла алмаза пространственная. Алмаз и графит – это прочно связанные между собой тетраэдры, внутри которых атомы с ковалентной связью удалены друг от друга на равные расстояния. Доля углерода приближается к 99,8%. Незначительные примеси влияют на «чистоту» и оттенок самородка. Известно о химической стойкости к воздействию кислот и щелочей.
Важно помнить о том, что при высокой температуре сжигания от 800 до 1000 градусов на воздухе молекулы алмаза превращаются в кучку графита.
Сущность кристаллической решетки графита состоит из слоев. Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения».
Физические свойства
Различие в строении алмаза и графита обуславливает и разные физические свойства:
- Твердость. Алмаз – это самый твердый и плотный из созданных природой минералов. Он обладает минимальным коэффициентом сжатия. Графит имеет мягкую структуру, на ощупь жирный. Несмотря на разное значение плотности, оба они хрупкие и рассыпаются при падении или ударе.
- Прозрачность. Непрозрачный, серый или темно-серый графит поглощает свет. При трении отслаивается и оставляет темные следы на поверхности. Металлические включения дают самородку блеск. Строение кристаллов в алмазе дает прозрачность. Природные самоцветы не всегда абсолютно прозрачные и бесцветные. Некоторые имеют цветной оттенок. Мутные кристаллы ценятся ниже.
- Теплопроводность. Алмаз обладает самым высоким показателем, в сравнении с другими твердыми телами. Отличный полупроводник, способный работать при высоких температурах. У графита этот показатель теплопроводности крайне низкий.
- Электропроводность. Если замерять этот параметр вдоль слоев графита, результат окажется довольно высоким, приближенным к металлу. Поперек плоскостей он в сотни раз меньше, а самый высокий – у рекристаллизованного графита. Алмаз не проводит электричество, он – диэлектрик.
Графен
Вместо того чтобы сжимать и нагревать графит, мы, следуя за Андреем Геймом и Константином Новоселовым, приклеим к кристаллу графита кусочек скотча. Затем отклеим его — на скотче останется тонкий слой графита. Повторим эту операцию еще раз — приложим скотч к тонкому слою и снова отклеим. Слой станет еще тоньше. Повторив процедуру еще несколько раз, мы получим графен — материал, за который вышеупомянутые британские физики получили Нобелевскую премию в 2010 году.
Графен представляет собой плоский монослой из атомов углерода, полностью идентичный атомарным слоям графита. Его популярность связана с необычным поведением электронов в нем. Они двигаются так, словно бы вовсе не обладают массой. В действительности, конечно, масса электронов остается все той же, что и в любом веществе. Во всем «виноваты» атомы углерода графенового каркаса, притягивающие заряженные частицы и образующие особенное периодическое поле.
Устройство на основе графена. На заднем плане фотографии — золотые контакты, над ними находится графен, выше — тонкий слой полиметилметакрилата
Engineering at Cambridge / flickr.com
Поделиться
Следствием такого поведения стала большая подвижность электронов — они перемещаются в графене гораздо быстрее, чем в кремнии. По этой причине многие ученые надеются, что основой электроники будущего станет именно графен.
Интересно, что у графена есть углеродные собратья — пентаграфен и фаграфен. Первый из них состоит из немного искаженных пятиугольных секций и, в отличие от графена, плохо проводит электрический ток. Фаграфен состоит из пяти-, шести- и семиугольных секций. Если свойства графена одинаковы во всех направлениях, то фаграфен будет обладать выраженной анизотропией свойств. Оба этих материала были предсказаны теоретически, но в реальности пока не существуют.
Обломок кремниевого монокристалла (на переднем плане) на вертикальном массиве углеродных нанотрубок
zeiss.com
Отличия между графитом и алмазом
При сравнении основных характеристик обнаруживаются существенные различия. Некоторые качественные параметры прямо противоположные.
По десятибалльной шкале Мооса алмаз имеет твердость, равную 10, а графит – 1.
Свет может легко проходить сквозь кристалл самоцвета. Используя это свойство, самоцвет гранят особым образом и получают бриллиант. Отраженные от граней лучи играют всеми цветами радуги. Графит непрозрачный и поглощает свет.
Графит обладает магнитной восприимчивостью.
Теплопроводность алмаза – от 900 до 2300, а графита – не выше 350 Вт/(м·К). Первый является диэлектриком, а электропроводимость второго приближается к показателям металлов.
Интересно, что при нагреве алмаз сохраняется до 720 градусов по Цельсию, а графит – до 3700. При нагревании до 700 градусов по Кельвину графит сжимается, а при дальнейшем росте температуры – расширяется.
Карбин
Говоря о вытянутых структурах из атомов углерода, нельзя не упомянуть карбины. Это линейные цепочки, которые по оценкам теоретиков могут оказаться самым прочным материалом из возможных (речь идет об удельной прочности). К примеру, модуль Юнга для карбина оценивается в 10 гиганьютон на килограмм. У стали этот показатель в 400 раз меньше, у графена — по меньшей мере в два раза меньше.
Тонкая нить, тянущаяся к железной частице внизу — карбин
Wikimedia Commons
Поделиться
Карбины бывают двух типов, в зависимости от того, как устроены связи между атомами углерода. Если все связи в цепочке одинаковые, то речь идет о кумуленах, если же связи чередуются (одинарная-тройная-одинарная-тройная и так далее), то о полиинах. Физики показали, что нить карбина можно «переключать» между этими двумя видами путем деформации — при растяжении кумулен превращается в полиин. Интересно, что это радикально меняет электрические свойства карбина. Если полиин проводит электрический ток, то кумулен— диэлектрик.
Главная сложность в изучении карбинов — их очень сложно синтезировать. Это химически активные вещества, к тому же легко окисляющиеся. На сегодняшний день получены цепочки длиной лишь в шесть тысяч атомов. Чтобы достигнуть этого, химикам пришлось растить карбин внутри углеродной нанотрубки. Кроме того, синтез карбина поможет побить рекорд размера затвора в транзисторе — его удастся уменьшить до одного атома.
Как получить из графита алмаз
Запасы природных ископаемых конечны. Промышленность стремительно развивается. Алмаз и графит применяют с целью роста потребности в материалах с данными свойствами. Если исходные минералы состоят из одного и того же элемента, можно ли получить из графита алмаз?
В естественных условиях самородки алмаза образовались при высоком давлении и резком охлаждении. В лаборатории смоделировали взрыв, получив переход графита во множество маленьких кристаллов алмаза. После многочисленных опытов, когда графит нагревали до разных температур при разных сочетаниях давления, ученые разработали методику получения искусственных алмазов.
Процесс заключается в преобразовании ковалентных связей. Кристаллическая решетка графита разрушается под воздействием высокой температуры и давления. При использовании катализатора вырастает новый кристалл – алмаз. Технология сложная. Все происходит в прочной камере. Пресс создает высокое давление в 1010 Па. «Раствор» графита, смешанного с агентом, нагревают почти до 3000 градусов с помощью электрического тока. После синтеза алмаза температуру и давление постепенно снижают.
Кристаллы получаются с требуемыми свойствами, но непрозрачные. Для массового использования в промышленности «чистота» — не решающий показатель. С середины прошлого века искусственный алмаз заменил в технических изделиях свой природный аналог. Выращивание крупных и чистых кристаллов оказалось делом дорогим и нерентабельным.
«Взрыв», или «ударная волна», широко не используется. Работы по изучению этого метода продолжаются. Прозрачные кристаллы, полученные таким образом, сходны с природными образцами, но размер их маленький.
Углеродные нанотрубки
Представьте себе, что вы свернули небольшой кусочек графенового листа в трубку и склеили ее края. Получилась полая конструкция, состоящая из тех же самых шестиугольников атомов углерода, что и графен и графит, — углеродная нанотрубка. Этот материал во многом родственен графену — он обладает высокой механической прочностью (когда-то из углеродных нанотрубок предлагали строить лифт в космос), высокой подвижностью электронов.
Однако есть одна необычная особенность. Графеновый лист можно скручивать параллельно воображаемому краю (стороне одного из шестиугольников), а можно и под углом. Оказывается, от того, как мы скрутим углеродную нанотрубку, будут очень сильно зависеть ее электронные свойства, а именно: будет она больше похожа на полупроводник с запрещенной зоной или на металл.
Многослойная углеродная нанотрубка
Wikimedia commons
Поделиться
Когда углеродные нанотрубки наблюдались впервые, достоверно неизвестно. В 1950–1980-х года разные группы исследователей, занимавшихся катализом реакций с участием углеводородов (например, пиролиза метана), обращали внимание на продолговатые структуры в саже, покрывавшей катализатор. Сейчас, чтобы синтезировать углеродные нанотрубки только конкретного вида (конкретной хиральности), химики предлагают использовать специальные затравки. Это небольшие молекулы в виде колец, состоящих, в свою очередь, из шестиугольных бензольных колец. Про работы по их синтезу можно почитать, например, здесь.
Как и графен, углеродные нанотрубки могут найти большое применение в микроэлектронике. Уже сейчас созданы первые транзисторы на нанотрубках, превосходящие по своим свойствам традиционные кремниевые приборы. Кроме того, нанотрубки легли в основу транзистора с самым маленьким затвором в мире.
Применение алмаза и графита
Оба эти вещества используются человеком как в промышленности, так и в быту. Характерные свойства обуславливают область применения.
Различают ювелирные и технические алмазы. В ювелирном деле используется не более 22% самоцветов. Для этого отбирают лучшие, как правило, природные камни. Их гранят, учитывая структуру. Из полученных бриллиантов создают всевозможные украшения. Синтетические камни тоже используют. Изделия из них выглядят красиво, но есть отличия. Наличие мельчайших вкраплений, оттенок граней и влияние магнита выдадут искусственный бриллиант.
В технических изделиях используют второсортный материал. В справедливое дело идут целые кристаллы, осколки и даже «пыль» от шлифовки минерала. На подшипники, наконечники буров, сверла отбирают алмазы соответствующего вида и размера. Необработанные кристаллы с острой верхушкой применяются в электронике. Мелкие, с дефектами экземпляры и осколки измельчают в алмазный порошок. Крошка напыляется на кромки и плоскости режущих и точильных дисков, шлифовальных кругов.
Есть утверждение, что при бурении скважин в плотных породах применение алмазной коронки дает экономию времени, ресурсов и снижает общие затраты. Инструменты с алмазным напылением предназначены для шлифовки поверхностей. С давних пор алмаз применяется для резки стекла, металла и других материалов. Часовая промышленность не обходится без этих камней. Более тысячи промышленных товаров содержат различные виды самоцветов.
Сфера применения графита также обширна. В быту минерал используют при изготовлении грифелей для карандашей. Графит – основа твердых смазочных материалов и входит в состав пластмасс, красок, электропроводящих клеев. В электрических машинах присутствует в щетках, токосъемниках, реостатах и везде, где нужен подвижный электроконтакт. В металлургии при выплавке стали и алюминия применяют необработанный графит и сажу.
В ядерной энергетике графитовые стержни, замедляющие нейтроны в ядерных реакторах, – важнейший элемент реактора. В военных и космических целях применяется для защиты корпуса ракеты от перегрева.
Месторождения минералов
Алмазы зарождаются на глубине 100 км и при температуре 1300 градусов. Кимберлитовая магма, которая образует кимберлитовые трубки, вступает в действие в результате взрывов. Именно такие трубки и представляют собой коренные месторождения алмазов. Впервые подобная трубка была открыта в африканской провинции Кимберли, откуда и пошло ее название.
Наиболее известные месторождения находятся в Индии, России и Южной Африке. На коренные месторождения приходится 80 % всех добываемых алмазов.
Чтобы найти алмаз в природе, используют рентген. Большинство из камней, которые находят, непригодны для ювелирного производства, так как обладают значительным количеством дефектов, в том числе трещинами, включениями, посторонними оттенками флуоресценцией и так далее. Поэтому их применение техническое. Такие камни делят на три категории:
- борт — камни с зональной структурой;
- баллас — камни, которые обладают круглой или грушевидной формой;
- карбонадо — черный алмаз.
Алмазы большого размера с выдающимися характеристиками, как правило, получают свое название. Кроме того, высокая стоимость камня делает его желанным для многих, что гарантирует «кровавую историю».
Графит образуется в результате изменения осадочных пород. В Мексике и на Мадагаскаре можно встретить руду с графитом низкого качества. Наиболее известные месторождения — в Краснодаре и на Украине.
Q-углерод
Среди недавно открытых форм углерода можно отметить так называемый Q-углерод. Впервые он был синтезирован американскими материаловедами из Университета Северной Каролины в 2015 году. Ученые облучали аморфный углерод с помощью мощного лазера, локально разогревая материал до 4000 градусов Цельсия. В результате примерно четверть всех атомов углерода в веществе принимала sp2-гибридизацию, то есть то же электронное состояние, что и в графите. Остальные атомы Q-углерода сохраняли гибридизацию, характерную для алмаза.
Q-углерод
ncsu.edu
Поделиться
В отличие от алмаза, графита и других форм углерода, Q-углерод оказался ферромагнетиком, таким как магнетит или железо. При этом его температура Кюри составила около 220 градусов Цельсия — только при таком нагреве материал терял свои магнитные свойства. А при допировании Q-углерода бором физики получили еще один углеродный сверхпроводник, с температурой перехода уже около 58 кельвинов.
Фуллерены
Хотя шестиугольник — одна из самых стабильных конфигураций, которые могут образовывать атомы углерода, есть целый класс компактных объектов, где встречается правильный пятиугольник из углерода. Эти объекты называются фуллеренами.
В 1985 году Гарольд Крото, Роберт Кёрл и Ричард Смолли исследовали пары углерода и то, в какие фрагменты слипаются атомы углерода при охлаждении. Оказалось, что в газовой фазе есть два класса объектов. Первый — кластеры, состоящие из 2–25 атомов: цепочки, кольца и другие простые структуры. Второй — кластеры, состоящие из 40–150 атомов, не наблюдавшиеся ранее. За следующие пять лет химикам удалось доказать, что этот второй класс представляет собой полые каркасы из атомов углерода, наиболее устойчивый из которых состоит из 60 атомов и повторяет по форме футбольный мяч. C60, или бакминстерфуллерен, состоял из двадцати шестиугольных секций и 12 пятиугольных, скрепленных между собой в сферу.
Открытие фуллеренов вызвало большой интерес химиков. Впоследствии был синтезирован необычный класс эндофуллеренов — фуллеренов, в полости которых находился какой-либо посторонний атом или небольшая молекула. К примеру, всего лишь год назад в фуллерен впервые поместили молекулу плавиковой кислоты, что позволило очень точно определить ее электронные свойства.
Фуллериты — кристаллы фуллеренов
Wikimedia Commons
Поделиться
В 1991 году оказалось, что фуллериды — кристаллы фуллеренов, в которых часть полостей между соседними многогранниками занимают металлы, — это молекулярные сверхпроводники с рекордно высокой температурой перехода для этого класса, а именно 18 кельвин (для K3C60). Позднее нашлись фуллериды и с еще большей температурой перехода — 33 кельвина, Cs2RbC60. Такие свойства оказались напрямую связаны с электронной структурой вещества.
Таблица
В компактной таблице приведены примеры, в чем разница между графитом и алмазом. Различия между этими состоящими из углерода минералами прекрасно иллюстрируют, насколько непохожими могут быть разные аллотропные формы одного и того же химического элемента.
| Графит | Алмаз | |
| Из чего состоит | Углерод, имеет слоистую структуру | Углерод, имеет кубическую кристаллическую решетку |
| Распространение в природе | Распространен широко. В России – на Кольском полуострове, на Урале и в Сибири | Распространен относительно широко, но из-за трудностей добычи и обработки изделия из алмаза имеют высокую стоимость |
| Применение | Широкое применение в самых разных отраслях промышленности: при производстве карандашей, различных смазок, в атомной, космической отраслях, в металлургии и некоторых других | Ювелирная промышленность, производство рабочих частей режущих и абразивных инструментов, последнее время –в радиоэлектронной промышленности |