Не каждый знает, но алмаз и графит — две формы одного и того же вещества. Эти минералы полностью отличаются друг от друга по твердости и по характеристикам преломления и отражения света. Причем отличия весьма существенные. Алмаз — наиболее твердый в мире минерал, по шкале Мооса он представляет собой эталон — 10, тогда как твердость графита по этой шкале — всего 2. Таким образом, алмаз и графит одновременно самые похожие и непохожие вещества в мире.
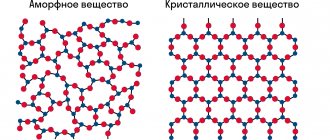
Кристаллические решетки алмаза и графита
Каждое из них происходит из углерода, который, в свою очередь, является самым распространенным элементом биосферы. Он присутствует как в атмосфере, так и в воде, в биологических объектах. В земле он представлен в составе нефти, газа, торфа и так далее. Встречается и в качестве залежей графита и алмаза.
Больше всего углерода в организмах. Боле того, ни один из них не может без него обойтись. А происхождение этого минерала в остальных частях планеты как раз и объясняется нахождением когда-то там живых организмов.
Много споров сопровождает вопрос, откуда взялся графит и алмазы, ведь недостаточно, чтобы был один углерод, необходимо также, чтобы выполнялись определенные условия, при которых этот химический элемент принимал новую структуру. Считается, что происхождение графита метаморфическое, а алмазов — магматическое. Это означает, что образование алмазов на планете сопровождают сложные физические процессы, скорее всего, в глубинных слоях земли при горении и взрывах в присутствии кислорода. Ученые предполагают, что в этот процесс также замешан метан, но точно никто не знает.
Мифы и заблуждения об алмазе и графите
Долгое время считалось, что непохожие друг на друга диамант и графит – это разные вещества. В 1797 г. ученый-химик С. Теннант провел серию опытов, в которых сравнил состав, доказав, что в их основе лежит углерод.
При сравнении строения алмаза и графита на атомном уровне выявляется существенная разница:
- Диамант имеет кристаллическую решетку в форме тетраэдра, где каждый атом окружен 4 другими атомами, являясь вершиной соседнего тетраэдра. Они похожи на соты, только в формате 3D. Такое строение дает прочные связи между молекулами вещества.
- Графит тоже представлен шестиугольниками, но они расположены горизонтальными пластами, между которыми нет прочной связи. Это делает его мягким, податливым.
Свойства алмаза и графита зависят от строения кристаллической решетки, потому кардинально различаются, общей у них является способность проводить тепло, нагреваясь при этом. Если провести сравнение по остальным показателям, то они отличаются:
- графит оставляет жирный след на бумаге, диамант – нет;
- самоцвет представлен разной цветовой гаммой, его непохожий «собрат» – одной;
- кристалл – эталон твердости, тогда как второй углеродный материал крошится при малейшем нажатии;
- сферы использования различны.
Теплопроводность алмаза
Теплопроводность алмаза [ 0 35 кал / ( см-сек — С) ] выше теплопроводности твердых сплавов [ 0 05 — 0 19 кал / ( см-сек — С) 1 и быстрорежущей стали [ 0 05 — 0 07 кал / ( см-сек — С) 1, поэтому образующееся при резании тепло отводится от резца в алмазном инструменте быстрее, чем в твердосплавном.
Теплопроводность алмаза также самая высокая среди минералов, что позволяет алмазному вооружению быстро охлаждаться.
Это свойство важно для предупреждения разрушения алмазов при быстром нагревании и термическом растрескивании.
Уменьшение теплопроводности алмазов типа Па, вызванное облучением быстрыми электоонами ( 1.5 MsBV и связанное г ним тепловое rnnnn.
Температурный ход теплопроводности алмазов различных типов обнаруживает ее пик, приходящийся на интервал температур 60 — 100 К [340], который в силу высокой температуры Дебая максимально сдвинут в область более высоких температур по сравнению с другими кристаллическими материалами.
В отличие от монокристаллов теплопроводность поликристаллическнх алмазов изучена слабо. По этому вопросу имеются только единичные публикации. Для природных поликристаллических алмазов данные о теплопроводности отсутствуют.
С алмаза на 50 % выше, чем теплопроводность алмаза природного, в котором содержание изотопа С составляет 98 9 %, и при комнатной температуре оказалась самой высокой из всех материалов, когда-либо созданных природой или человеком.
Температурная зависимость теплопроводности алмазов представлена на рис. 12.1.7, а на рис. 12.1.8 показано изменение теплопроводности с концентрацией изотопа 13С при фиксированной температуре.
Полученные нами результаты, в частности, объясняют независимость теплопроводности алмаза от температуры — факт, который находится в противоречии с теорией Пайерлса — Дебая.
Вт; ko — коэффициент интенсивности теплообмена, зависящий от значений теплопроводности алмазов, матрицы и корпуса коронки, геометрических размеров коронки, вида и расхода очистного агента, зернистости и концентрации объемных алмазов, Вт / С, t — температура потока очистного агента на подходе к коронке, С.
С алмаза на 50 % выше, чем теплопроводность алмаза природного, в котором содержание изотопа С составляет 98 9 %, и при комнатной температуре оказалась самой высокой из всех материалов, когда-либо созданных природой или человеком. Температурная зависимость теплопроводности алмазов представлена на рис. 12.1.7, а на рис. 12.1.8 показано изменение теплопроводности с концентрацией изотопа 13С при фиксированной температуре.
В ИК-поглощении им соответствуют спектры, содержащие соответственно А и В полосы поглощения в однофононной области. Это предположение дало возможность удовлетворительно объяснить результаты исследования теплопроводности природных азотсодержащих алмазов.
В ИК-поглощении им соответствуют спектры, содержащие соответственно А и В полосы поглощения в однофононной области. Это предположение дало возможность удовлетворительно объяснить результаты исследования теплопроводности природных азотсодержащих алмазов.
Физические и химические свойства минералов
Химическая формула алмаза и графита едина – это углерод, обозначенный в таблице Менделеева как С. В самоцвете имеются примеси магния, железа, азота, алюминия, что придает ему цвет.
Тип кристаллической решетки алмаза кубический, графита – гексагональный. Это объясняет то, что твердость алмаза в 5 раз больше, чем у его «собрата».
Структура алмаза двояка – минерал твердый, но при этом хрупкий. У графита, состоящего из чешуек, она слоистая. Сравнение структуры дает ответ о различии оптических свойств – первый проводит через себя свет, а второй – нет.
Сравнение физических свойств алмаза и графита представлено в таблице:
| Критерий | Алмаз | Графит |
| Кристаллическая решетка | Кубическая | Плоская |
| Прозрачность | Прозрачен, полупрозрачен, реже мутный | Непрозрачен |
| Электропроводность | Отсутствует | Хорошая |
| Теплопроводность | Присутствует | Присутствует |
| Температура плавления | 4000 °С | 3890 °С |
| Цвет | Бесцветный, голубой, белый, желтый и др | Серый |
| Плотность | 3,56 кг/ м³ | 2,23 кг/ м³ |
| Агрегатное состояние | Твердое | Твердое |
| Твердость по шкале Мооса | 10 | 2 |
Идеальные и реальные кристаллы. Выращивание кристаллов
Идеальный кристалл является, по сути, математическим объектом, имеющим полную, свойственную ему симметрию, идеализированно равные грани.
Реальный кристалл всегда содержит различные дефекты, искажения и неровности на гранях, имеет пониженную симметрию многогранника вследствие условий роста, неоднородности питающей среды, повреждений и деформации. Реальный кристалл не обязательно обладает гранями правильной формы, но у него сохраняется главное свойство – закономерность положение атомов в кристаллической решетке. Каждое кристаллическое вещество имеет определенную свойственную ему пространственную форму. Например, для хлорида натрия – это куб, для алюминиевых квасцов – октаэдр. И даже, если сначала такой кристалл имел неправильную форму, он все равно рано или поздно превратится в куб или октаэдр. Более того, если кристалл с правильной формой специально испортить – отбить у него вершины, повредить ребра и грани, то он при дальнейшем росте начнет самостоятельно «залечивать» свои повреждения. Чтобы убедиться в этом был проведен такой опыт: из кристалла поваренной соли выточили шар, а потом поместили его в насыщенный раствор; через некоторое время кристалл сам постепенно принял форму куба! Но добиться идеальной формы кристаллов в земных условиях практически не возможно потому, что при выращивании на него действует сила тяжести, которая способствует деформации граней. Поэтому проводили опыты по выращиванию кристаллов в условиях невесомости на борту космических кораблей.
Как же выращивают кристаллы? Вот простая модель, поясняющая суть кристаллизации. Представим, что в большом зале укладывают паркет. Легче всего работать с плитками квадратной формы – как ее не поверни, она все равно подойдет к своему месту. Труднее выложить паркет из прямоугольных дощечек, особенно если у них с боков есть пазы и выступы – тогда каждую дощечку можно уложить на свое место единственным способом. Особенно трудно выложить узор из дощечек сложной формы – напоминает сборку пазлов. Если паркетчик очень торопится, то плитки будут поступать к месту укладки очень быстро – правильного узора не получится, появятся пустоты. Примерно те же процессы происходят при росте кристаллов, только сложность еще заключается и в том, что частички должны укладываться не в плоскости, а в пространстве. Они непрерывно совершают тепловые движения и «ищут» самое удобное для себя место – энергетически выгодное положение. Попав на такое место на поверхности растущего кристалла, частичка вещества может там остаться и через некоторое время оказаться внутри, под новыми наросшими слоями. Но возможен и другой исход – частичка вновь уйдет с поверхности в раствор снова начнет «искать», где ей удобнее устроиться.
Для выращивания кристаллов нужны условия: высокое давление, вакуум, температура. Кристаллы некоторых веществ можно получить в школьной лаборатории. Чтобы вырастить кристаллы медного купороса, мы получили насыщенный раствор. Перелили его в стакан, где будет расти кристалл. Вода не должна остывать, поэтому стакан с раствором поставили в емкость с горячей водой. К нитке привязали кристаллик, а ее к стержню, который положили на стакан и кристаллик окунули в раствор. Поставили стакан туда, где нет сквозняков, вибрации, сильного света. Накрыли стакан бумагой от попадания пыли и мусора. Через 2-3 дня кристаллик начал расти. При выращивании нужно помнить:
Кристаллик нельзя без особой причины вынимать из раствора.
Периодически менять или обновлять насыщенный раствор.
Медный купорос образует кристалл синего цвета ромбовидной формы, похож на драгоценный камень.
Применение кристаллов.
Для чего нужны кристаллы?
Применения кристаллов в промышленности так многочисленны и разнообразны, что их трудно перечислить. Поэтому ограничимся несколькими примерами. (презентация «применение кристаллов»)
Самый твердый и самый редкий из природных минералов – алмаз. Сегодня алмаз в первую очередь камень-работник, а не камень-украшение.
Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни. Алмазная пила — это большой (до 2-х метров в диаметре) вращающийся стальной диск, на краях которого сделаны надрезы или зарубки. Мелкий порошок алмаза, смешанный с каким-нибудь клейким веществом, втирают в эти надрезы. Такой диск, вращаясь с большой скоростью, быстро распиливает любой камень.
Колоссальное значение имеет алмаз при бурении горных пород, в горных работах.
В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия.
Алмазным порошком шлифуют и полируют твердые камни, закаленную сталь, твердые и сверхтвердые сплавы. Сам алмаз можно резать, шлифовать и гравировать тоже только алмазом. Наиболее ответственные детали двигателей в автомобильном и авиационном производстве обрабатывают алмазными резцами и сверлами.
Рубин и сапфир относятся к самым красивым и самым дорогим из драгоценных камней. У всех этих камней есть и другие качества, более скромные, но полезные. Кроваво-красный рубин и лазарево-синий сапфир — это родные братья, это вообще один и тот же минерал — корунд, окись алюминия А12О3. Разница в цвете возникла из-за очень малых примесей в окиси алюминия: ничтожная добавка хрома превращает бесцветный корунд в кроваво-красный рубин, окись титана — в сапфир. Есть корунды и других цветов. Есть у них ещё совсем скромный, невзрачный брат: бурый, непрозрачный, мелкий корунд — наждак, которым чистят металл, из которого делают наждачную шкурку. Корунд со всеми его разновидностями — это один из самых твердых камней на Земле, самый твердый после алмаза. Корундом можно сверлить, шлифовать, полировать, точить камень и металл. Из корунда и наждака делают точильные круги и бруски, шлифовальные порошки.
Вся часовая промышленность работает на искусственных рубинах. На полупроводниковых заводах тончайшие схемы рисуют рубиновыми иглами. В текстильной и химической промышленности рубиновые нитеводители вытягивают нити из искусственных волокон, из капрона, из нейлона.
Новая жизнь рубина — это лазер или, как его называют в науке, оптический квантовый генератор (ОКГ), чудесный прибор наших дней. В 1960г. был создан первый лазер на рубине. Оказалось, что кристалл рубина усиливает свет. Лазер светит ярче тысячи солнц. Мощный луч лазера громадный мощностью. Он легко прожигает листовой металл, сваривает металлические провода, прожигает металлические трубы, сверлит тончайшие отверстия в твердых сплавах, алмазе. Эти функции выполняет твердый лазер, где используется рубин, гранат с неодитом. В глазной хирургии применяется чаще всего неодиновые лазеры и лазеры на рубине. В наземных системах ближнего радиуса действия часто используются инжекционные лазеры на арсениде галлия.
Появились и новые лазерные кристаллы: флюорит, гранаты, арсенид галлия и др.
Сапфир прозрачен, поэтому из него делают пластины для оптических приборов.
Основная масса кристаллов сапфира идет в полупроводниковую промышленность.
Кремень, аметист, яшма, опал, халцедон — все это разновидности кварца. Мелкие зернышки кварца образуют песок. А самая красивая, самая чудесная разновидность кварца — это и есть горный хрусталь, т. е. прозрачные кристаллы кварца. Поэтому из прозрачного кварца делают линзы, призмы и др. детали оптических приборов.
Кристаллы сыграли важную роль во многих технических новинках 20 в. Некоторые кристаллы генерируют электрический заряд при деформации. Первым их значительным применением было изготовление генераторов радиочастоты со стабилизацией кварцевыми кристаллами. Заставив кварцевую пластинку вибрировать в электрическом поле радиочастотного колебательного контура, можно тем самым стабилизировать частоту приема или передачи.
Полупроводниковые приборы, революционизировавшие электронику, изготавливаются из кристаллических веществ, главным образом кремния и германия. При этом важную роль играют легирующие примеси, которые вводятся в кристаллическую решетку. Полупроводниковые диоды используются в компьютерах и системах связи, транзисторы заменили электронные лампы в радиотехнике, а солнечные батареи, помещаемые на наружной поверхности космических летательных аппаратов, преобразуют солнечную энергию в электрическую. Полупроводники широко применяются также в преобразователях переменного тока в постоянный.
Кристаллы используются также в некоторых мазерах для усиления волн СВЧ — диапазона и в лазерах для усиления световых волн. Кристаллы, обладающие пьезоэлектрическими свойствами, применяются в радиоприемниках и радиопередатчиках, в головках звукоснимателей и в гидролокаторах. Некоторые кристаллы модулируют световые пучки, а другие генерируют свет под действием приложенного напряжения. Перечень видов применения кристаллов уже достаточно длинен и непрерывно растет.
Сходство и взаимопревращения алмаза и графита
У мягкого серого графита и твердого прозрачного алмаза общая основа – углерод, т. е. они состоят из одного вещества. Это натолкнуло ученых на мысль о попытке преобразовать графит в алмаз.
Получить алмаз из графита можно в лаборатории или домашних условиях. В первом случае нужны следующие условия:
- газовая среда (метан);
- давление более 50 тысяч атмосфер;
- температура выше 1200 °С;
- наличие катализаторов (платины, никеля, железа).
Для домашних экспериментаторов есть 2 способа. В первом понадобится:
- источник тока;
- графит;
- холодная вода или жидкий азот;
- провод.
Провод привязывается к графиту, опускается в емкость. После охлаждения в морозильной камере или с помощью жидкого азота через полученную конструкцию с проводом пропускается ток. Это способствует перестройке кристаллической решетки, быстрому преобразованию в самоцвет.
Второй способ предполагает появление алмаза из смеси соли, графита и дистиллированной воды. Нить опускается в банку с подготовленным раствором, на ней постепенно нарастает кристалл.
Получить графит из кристалла можно путем его нагревания от 1000 °С, при температуре от 1750 °С процесс происходит быстро.
Также смотрите обратный способ получения графита из искусственных алмазов:
Определение
Алмаз – минерал, основой которого является углерод. Характеризуется метастабильностью, то есть способностью в обычных условиях неограниченно долго существовать в неизменном виде. Помещение алмаза в специфические условия, например в вакуум при повышенной температуре, приводит к его переходу в графит.
Алмаз
Графит – минерал, выступающий модификацией углерода. При трении от общей массы вещества отделяются чешуйки. Наиболее известное применение графита – изготовление из него карандашного грифеля.
Графит
Области применения углеродных минералов
Углеродные минералы обладают большим спектром свойств, позволяющих применять их в разных областях жизни. Встретить их можно в кольце, карандаше, приборе для резки металла, стекла. Если провести сравнение сфер использования, то можно увидеть, что они пересекаются только в одной точке – взаимопревращении.
Алмаз
Основная область применения минералов – ювелирное дело. В процессе обработки камень становится бриллиантом, обретая высокую цену. Вторая роль самоцвета – материальная.
Для некоторых бриллианты – это вариант капиталовложения.
Посмотреть эту публикацию в Instagram
Публикация от Ювелирный магазин «АЛМАЗ» (@almazz_66) 5 Июн 2019 в 10:50 PDT
Не всегда самоцвет идеален по цвету и прозрачности. Встречаются мутные образцы, в ходе ювелирной обработки остаются мелкие осколки, которые невозможно приспособить для инкрустации украшений. Они используются в точных приборах:
- электрической технике;
- радиоэлектронике;
- стеклорезах;
- силовой электронике;
- буровых установках.
Графит
Основные сферы применения:
- огнестойкое оборудование;
- смазочные материалы;
- карандашные грифели;
- замедлитель нейтронов в ядерной энергетике;
- создание искусственных алмазов.
Алмаз может использоваться только как твердый кристалл, графит – как жирная паста и твердый предмет.
В дополнение смотрите видео:
Применение в промышленности
Алмаз не царапается ни одним из существующих элементов на Земле. Это замечательное свойство получило широкое распространение в области народного хозяйства. Два аллотропных состояния одного химического элемента углерода – графит и алмаз, а имеют столь разное применение. Графит наименьшей твердостью используется в качестве сухой смазки в механизмах трения, тогда как алмаз с наивысшей твердостью по шкале Мооса, применяется в качестве абразивного материала. Буровые коронки с алмазным напылением, шлифовальные круги – это малая часть орудий производства по обработке материалов.
Алмаз нашел своё применение и в изучении космоса в качестве теплоотводящего материала при экстремальных температурах.
Cтанция «Пионер», запущенная к Венере в 1978 году, была покрыта материалом из алмазной крошки.
Широкое применение технических образцов (искусственно полученных) известно в радиоэлектронике, оптических приборах, при производстве медицинских инструментов. Для нужд техники производится 500 млн карат искусственных алмазов, это 100 тонн ежегодно.
Сравнительная характеристика алмаза и графита
Анализ характеристик:
- Сравнение кристалла и графита с точки зрения неорганической химии указывает на то, что они одинаковы. Углерод – это основа состава.
- Сравнение на молекулярном уровне помогает понять причину такой разницы в свойствах. Расположение атомов и связей между ними делает одинаковое разным.
- Физические свойства различаются кардинально, кроме способности проводить тепло.
- Сравнение области применения говорит о том, что их используют исходя из строения кристаллической решетки, а не химического состава.
Сравнение состава, строения, применения двух разных веществ показывает, как похожее может обладать полярными характеристиками и свойствами.
Как вы думаете, при сравнении других веществ можно обнаружить сходство и различие одновременно? Поделитесь информацией с друзьями и знакомыми в соцсетях.
Что такое кристаллы и их разнообразие в природе
Интересно происхождение слова «кристалл». Оно звучит почти одинаково во всех европейских языках. Много веков назад, среди вечных снегов Альп, на территории современной Швейцарии, нашли очень красивые, совершенно бесцветные кристаллы, очень напоминающие чистый лед. Древние натуралисты так их и назвали «кристаллос», в переводе с греческого — лёд. Полагали, что лед, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять. Один из самых авторитетных философов античности Аристотель писал: «Кристаллос рождается из воды, когда она полностью утрачивает теплоту». Римский поэт Клавдиан описал тоже самое стихами:
Ярой альпийской зимой лед превращается в камень.
Солнце не в силах затем камень такой растопить.
Аналогичный вывод сделали в древнем Китае и Японии – лед и горный хрусталь обозначили одним и тем же словом. И даже в 19 веке нередко соединяли воедино эти образы.
Едва прозрачный лед, над озером тускнея,
Кристаллом покрывал недвижные струи.
А. С. Пушкин к Овидию
Кристаллов великое разнообразие. Они различны по цвету, прозрачности.
(презентация «разнообразие кристаллов»), А кто не любовался снежинками, разнообразие которых бесконечно! Еще в 17 веке знаменитый астроном Иоганн Кеплер написал трактат «О шестиугольных снежинках», а спустя три столетия были изданы альбомы, в которых представлены тысячи фотографий увеличенных снежинок, причем ни одна из них не повторяет другую. (презентация «снежинки»).
Фуллерен
Фуллерен, бакибол, или букибол — молекулярное соединение, принадлежащее к классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёх координированных атомов углерода. Уникальная структура фуллеренов обуславливает их уникальные физические и химические свойства. В соединении с другими веществами они позволяют получить материалы с принципиально новыми свойствами.
История добычи:
Открытие фуллерена произошло в результате экспериментов Смолли и Крото с инструментом, который Смолли изобрел для изучения молекул и атомных кластеров. Крото заинтересовала предложенная Смолли методика лазерного испарения. С ее помощью он намеревался проверить свою теорию о поведении углерода в межзвездном пространстве. Крото считал, что богатые углеродом красные гиганты способны испускать сложные углеродные соединения, которые можно обнаруживать с помощью радиотелескопов.
Структура фуллерена:
Атом связь Фуллерен является новой аллотропной формой углерода. Молекулы фуллерена состоят из 60,70 атомов, образующих сферу. Кристаллические фуллерены представляют собой полупроводники. Разнообразие физико-химических и структурных свойств соединений на основе фуллеренов позволяет говорить о химии фуллеренов как о новом перспективном направлении органической химии.
Атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Самый симметричный и наиболее полно изученный представитель семейства фуллеренов фуллерен (C60), в котором углеродные атомы образуют усечённый икосаэдр, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч.
Следующим по распространённости является фуллерен C70, отличающийся от фуллерена C60 вставкой пояса из 10 атомов углерода в экваториальную область C60, в результате чего молекула C70 оказывается вытянутой и напоминает своей формой мяч для игры в регби. Так называемые высшие фуллерены, содержащие большее число атомов углерода (до 400), образуются в значительно меньших количествах и часто имеют довольно сложный изомерный состав. Среди наиболее изученных высших фуллеренов можно выделить Cn, n=74, 76, 78, 80, 82 и 84.
Нитрил бора
Это вещество появилось сравнительно недавно: оно было синтезировано в лабораторных условиях в 1957 году, и оказалось значительно тверже алмаза. Одновременно оно превосходит его и по ряду других свойств. Например, при воздействии сверхвысоких температур вещество не растворяется в металлах, благодаря чему может использоваться для обработки стали. Слой нитрила углерода-бора наносится на инструмент в качестве режущей кромки для обработки всевозможных деталей, использующихся в самолетах и космических кораблях.
Природа удивительна и нас ждет еще множество невероятных открытий. Алмаз — далеко не самое твердое в мире вещество. Правда, поспорить с ним по красоте и привлекательности другим минералам непросто. Хотя нельзя исключать, что рано или поздно в продаже появятся обручальные кольца с фуллеритом или лонсдейлитом.
Понятие аллотропии
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство. Аллотропия — существование двух и более простых веществ одного и того же химического элемента. Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов.
Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени.
Это касается таких групп, как:
- неметаллы;
- полуметаллы;
- благородные газы;
- галогены.
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
- Различное количество атомов, необходимых для образования одной молекулы.
- Отличающийся порядок сопряжения атомов в одну молекулу.
- Параллели между спинами электронов.
- Разновидность кристаллической решетки.
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
Примеры аллотропии:
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390 ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540 ºС ведет к перестройке до центрировано-кубической структуры.
Различные вещества
- Алмаз. Минерал обладает высокой ценностью и после огранки используется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют основу всей решётки. Между атомами минерала существует прочная ковалентная связь. Для кристаллической решётки алмаза характерно плотное содержание атомов в виде куба. Другими словами, узлами считаются атомы углерода, а своеобразными гранями куба являются прочные ковалентные связи. Такой минерал считается самым прочным на планете, и неизвестно, сколько таких своеобразных кубов включает в себя цельный алмаз.
- Графит. Углерод также может быть и в другой кристаллической модификации. Атомная решётка данного элемента включает в себя только атомы углерода, ей присуща слоистая структура. В графите каждый атом связан тремя атомами углерода. Из-за этого он обладает металлическим блеском, высокой теплопроводностью.
- Кристаллическая решётка йода имеет молекулярный тип. Атомы молекул соединяются ковалентными связями, но молекулы химического элемента имеют слабые силы притяжения. Это характеризует йод тем, что он имеет малую твёрдость, низкую температуру плавления.
- Натрий. Представитель металлической кристаллической решётки. Между катионами, расположенными в узлах решётки, двигаются электроны. Они, присоединяясь к катионам, нейтрализуют их заряд, в свою очередь, нейтральные атомы отпускают часть электронов, преобразуясь в катионы. Такой тип кристаллической решётки наделяет металл пластичностью, электро- и теплопроводностью.
- Сухой лёд. Или оксид углерода в затвердевшем виде. Имеет молекулярную кристаллическую решётку в форме куба. Молекулы удерживаются между собой слабыми связями. иффузия читайте в нашей статье.
Это интересно: как определить валентность по таблице Менделеева?
Теория происхождения алмазов
Термин алмаз произошел из греческого языка от слова «адамас», который переводится как непревзойдённый. Сегодня пока не существует единого мнения касательно происхождения алмазов.
Наибольшей популярностью пользуется гипотеза, согласно которой минерал получился в процессе остывания силикатов мантии земной коры. А на поверхности земли он появился вследствие ряда очень мощных подземных взрывов.
Вюртцитный нитрид бора
Кристаллическая решетка этого вещества представляет собой особую форму, которую называют вюртцитной. Именно благодаря этому вещество является столь твердым. Если прикладывать к кристаллу нагрузку, атомы в кристаллической решетке будут особым образом перераспределяться, из-за чего вещество станет еще более твердым.
То есть чем больше нагрузка, тем тверже делается нитрид бора! Это свойство роднит его с лонсдейлитом — еще одним «конкурентом» алмаза, который образуется на дне воронок, оставленных графитовыми метеоритами. До сих пор не удалось точно установить, по каким причинам твердость минерала меняется при воздействии нагрузок.
К сожалению, вопрос остается открытым, так как экспериментировать с этим веществом довольно сложно, поскольку его нелегко синтезировать в лабораторных условиях.
Графит
Графи́т — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический).
Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода.
История добычи:
В 60-х годах XVI столетия в Англии. Местные пастухи, нашедшие залежи странного черно-блестящего материала, приняли его сначала за свинец, но, поняв, что пуль из него не отольешь, стали отбивать куски черного камня и метить им своих овец. На новый материал скоро обратили внимание художники и коммерсанты, быстро наладившие на английских улицах торговлю тонкими пластинками и кусочками графита. Конечно, пользоваться им было очень неудобно — руки пачкались! Приходилось обматывать графит веревкой, бумагой, а то и просто зажимать между дощечек. Так появились первые карандаши в деревянном корпусе.
Структура графита:
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
Известны две формы графита: альфа-графит (имеет гексагональную структуру и кристаллическую решетку) и бета-графит (имеет ромбоэдрическую структуру и кристаллическую решетку). У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у β-графита каждый четвёртый слой повторяет первый.
Альфа-графит может быть преобразован в бета-форму с помощью механической обработки. Бета-форма переходит в альфа-форму при нагревании графита свыше 1300 °C.
Лонсдейлит
Этот минерал очень похож на алмаз по своей молекулярной структуре. Его даже называют гексональным алмазом. Лонсдейлит также является одной из модификаций углерода.
Однако если это вещество загрязнено различными примесями, оно не может похвастаться особой твердостью. Но в очищенном виде он гораздо тверже, чем алмаз, и с легкостью может оставить на нем царапины. Чистый лонсдейлит на 58% прочнее алмаза, а при приложении к нему нагрузки прочность его лишь увеличивается. Кстати, механизм этого процесса для ученых все еще остается загадкой.
Очень интересна история его открытия. Впервые следы вещества удалось обнаружить на дне воронок, оставшихся после падения метеоритов. Метеориты эти, по-видимому, состояли преимущественно из графита. Из-за высокой температуры графит превратился в лонсдейлит. Минерал был найден в России на месте падения Тунгусского метеорита, а также в Америке в кратере Дьявола. Благодаря этому Лонсдейлит еще называют космическим алмазом.
Свое название минерал получил в честь ученого-минералога из Британии Кэтлин Лонсдейл. Идею дать ему именно такое название предложил другой минералог по имени Клиффорд Фрондель. Он пояснил эту мысль тем, что новая форма алмаза в природе столь же редка, как и женщина-ученый. Конечно, в наши дни это не столь актуально. В 1960-е же годы ситуация в науке была такой, что женщинам было сложно добиться больших научных высот.