Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах. Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
…
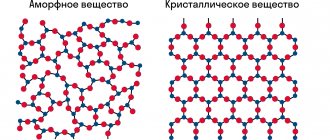
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.
Графит атомная кристаллическая решетка какая
В приведённой ниже таблице перечислены характерные свойства веществ с атомной и ионной кристаллическими решётками.
Характерные свойства веществ
— твёрдые при обычных условиях;
— в расплавах и растворах проводят электрический ток
| С атомной кристаллической решёткой | С ионной кристаллической решёткой |
Используя данную информацию, определите, какую кристаллическую решётку имеет:
1) хлорид кальция
;
2) графит
.
Запишите ответ в отведённом месте:
1) Хлорид кальция имеет
Хлорид кальция — вещество с ионной химической связью, тугоплавкое (Т пл = 772 °C), проводит электрический ток — имеет ионную кристаллическую решётку.
Графит — вещество с ковалентной неполярной химической связью, нелетучее, твёрдое — имеет атомную кристаллическую решётку.
Ответ: Хлорид кальция — ионная кристаллическая решётка, графит — атомная кристаллическая решётка.
Источник
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия
Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.
Определение
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Лечебное влияние
Графит обладает большим количество целебных свойств, что позволяет народной медицине активно применять его в качестве средства от болезней.
- Графит благоприятно воздействует на слои эпидермиса. Он используется при лечении кожных покровов от трещин, рубцов, синяков, экзем.
- Литотерапевты применяют графитовые изделия для лечения болезней в области носовых пазух. Камень помогает избавиться от сухости в слизистой оболочке носа, устранить различные хронические заболевания дыхательных путей, ринит, ларинготрахеит. Графит также используют в качестве профилактики лечения бронхиальной астмы.
- Камни графита способствуют улучшению состояния желудочно-кишечного тракта, налаживают процессы обмена веществ в организме, борются с хроническим гастритом, устраняют изжогу и снижают обострение запоров или диареи.
- Лечебный графит помогает справиться с сильной головной болью, апатией и стрессом.
- Графит оказывает целебное влияние на глаза человека. Маленькие камни снимают воспаление при ячмене, конъюнктивите, а также помогают в лечении катаракты или язвы роговицы.
- Минерал регулирует эмоциональный баланс, снижая уровень злости, вспыльчивости, агрессии, депрессии и неврастении.
Металлический тип
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
Источник
МОРФОЛОГИЯ
Хорошо сформированные кристаллы встречаются редко. Кристаллы пластинчатые, чешуйчатые, изогнутые, обычно несовершенной пластинчатой формы. Чаще всего это листья без кристаллографических очертаний и их агрегаты. Образует сплошные радиально-радиальные агрегаты скрытокристаллические, листовые или округлые, реже — сферулитовые агрегаты концентрически-зонального строения. В крупнокристаллических осадках часто наблюдается треугольная штриховка на плоскостях (0001).
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Источник
Описание графита:
Графит широко распространен в природе как минерал. Он встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию.
Природный графит по своему химическому составу не отличается чистотой. В большом количестве (до 10-25%) в нем присутствует зола, состоящая из разных составляющих (Fe2O3, SiO2, Аl2O3, MgO, Р2О5, CuO, СаО и др.), газы (до 2%) и битумы, иногда вода.
Также графит получается искусственным путем различными способами. Например, нагреванием смеси кокса и пека до 2 800 °C.
ПРОИСХОЖДЕНИЕ
Он образуется при высоких температурах в вулканических и магматических породах, пегматитах и скарнах. Он встречается в кварцевых жилах с вольфрамитом и другими минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Распространен в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные месторождения образуются в результате пиролиза угля под воздействием ловушек на угольных месторождениях (Тунгусский бассейн). Акцессорный минерал метеоритов. Попутные минералы: кварц, пирит, гранаты, шпинель.
Типы и марки графита:
В соответствии с ГОСТ 17022-81 «Графит. Типы, марки и общие технические требования» выделяют следующие минералогические типы графита:
Этим же ГОСТом предусмотрены следующие марки графита: ГСМ-1, ГСМ-2, ГАК-1, ГАК-2, ГАК-3, ГК-1, ГК-2, ГК-3, ГС-1, ГС-2, ГС-3, ГС-4, П, ЭУЗ-М, ЭУЗ-II, ЭУЗ-III, ЭУТ-I, ЭУТ-II, ЭУТ-III, ГТ-1, ГТ-2, ГТ-3, ГЭ-1, ГЭ-2, ГЭ-3, ГЭ-4, ГЛ-1, ГЛ-2, ГЛ-3, ЭУН, ГЛС-1, ГЛС-2, ГЛС-3, ГЛС-4.
Им соответствуют следующие виды использования (потребления) графита:
– графит специальный малозольный,
– графит кристаллический электроугольный,
– графит кристаллический литейный,
– графит скрытокристаллический электроугольный,
– графит скрытокристаллический литейный.
Структура и кристаллическая решетка графита:
Графит имеет слоистую, плоскую структуру. Отдельные слои графита называются графеном. Каждый слой кристаллической решетки графита может по-разному располагаться по отношению друг к другу, образуя политипы.
В каждом слое атомы углерода расположены в гексагональной решетке на расстоянии 0,142 Нм, а расстояние между плоскостями графена составляет 0,335 Нм.
Атомы углерода, расположенные в одной плоскости слоя, связаны между собой ковалентной связью. Углерод имеет четыре свободных электрона. Однако в ковалентной связи задействованы только три электрона из четырех, поэтому каждый атом углерода связан только с тремя атомами углерода. Четвертый электрон свободно мигрирует в плоскости, делая графит электропроводящим в направлении, параллельном плоскости. Электропроводность графита в направлении перпендикулярно плоскости слоя, наоборот, в сотни раз меньше.
Между собой слои графена в графите скреплены слабыми Вандерваальсовыми силами, которые позволяют слоям графита легко быть отделенными друг от друга.
Известны две формы графита: альфа-графит (имеет гексагональную структуру и кристаллическую решетку) и бета-графит (имеет ромбоэдрическую структуру и кристаллическую решетку). Обе формы графита имеют очень схожие физические свойства, за исключением того, что слои графена у каждой формы графита укладываются несколько по-разному.
Рис. 1. Альфа-графит
У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у β-графита каждый четвёртый слой повторяет первый.
Рис. 2. Бета-графит
Альфа-графит может быть преобразован в бета-форму с помощью механической обработки. Бета-форма переходит в альфа-форму при нагревании графита свыше 1300 °C.
Каким может быть графит и алмаз?
Внешность графита в любом его виде остается практически одинаковой. Он серый, может быть почти черным, имеет металлический блеск. Однако к металлам его относить нельзя, углерод им быть не может. При давлении графит всегда распадается чешуйками, а его жесткость может варьировать. Однако в любом случае с алмазом его сравнить нельзя.
Рассматривая бриллиант, то есть, ограненный алмаз, можно отметить прозрачность – хотя некоторые камни все же мутноваты, а еще они могут иметь различные оттенки. Но порошок из алмаза всегда будет белым, в то время как от графита он остается черным или серым. Несмотря на все изобилие природных вариаций, эти две формы углерода всегда сильно отличаются, перепутать их невозможно.
Свойства графита:
– электрическая проводимость графита анизотропна (т.е. зависит от направления внутри самого графита). Он хорошо проводит электрический ток в направлении, параллельном базисной плоскости. В этом случае его электропроводность близка к металлической. В перпендикулярном направлении электропроводность в сотни раз меньше.
– обладает низкой твёрдостью. Твердость школе Мооса 1.
– относительно мягкий. После воздействия высоких температур становится немного более твёрдым и очень хрупким,
– плотность 2,08-2,23 г/см³,
– легко поддается механической обработке,
– цвет от железо-черного до стально-серого, блеск металлический,
– жирный (скользкий) на ощупь, оставляет след на бумаге и пальцах,
– при трении графит расслаивается на отдельные чешуйки (это свойство используется в карандашах),
– обладает достаточно большой теплопроводностью. Теплопроводность графита анизотропна. Она составляет от 100 до 354,1 Вт/(м*К) и зависит от марки графита, от направления относительно базисных плоскостей и от температуры,
– коэффициент теплового расширения графита также анизотропен и зависит от температуры. До 700 К коэффициент теплового расширения графита отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей,
– обладает высоким диамагнетизмом,
– химически малоактивен,
– обладает химической стойкостью. Кислотоупорен,
– при высокой температуре реагирует с кислородом, сгорая до углекислого газа,
– образует соединение включения с щелочными металлами, солями.
Источник
Получение графита
: графит получают нагреванием антрацита без доступа воздуха.
ПРИМЕНЕНИЕ
Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой термостойкости графита (в отсутствие кислорода), его химической стойкости к ряду расплавленных металлов. Он используется в электродах, в нагревательных элементах, благодаря своей высокой электропроводности и химической стойкости практически ко всем агрессивным водным растворам (намного выше, чем у драгоценных металлов). Для производства химически активных металлов электролизом расплавов, твердых смазок, комбинированных жидких и пастообразных смазок, пластиковых наполнителей.
это замедлитель нейтронов в ядерных реакторах, компонент композиции для изготовления стержней с черным графитом (в смеси с каолином). Он используется для получения синтетических алмазов в качестве эталона длины нанометрового диапазона для калибровки сканеров микроскопа с туннельным эффектом и атомно-силового микроскопа, для изготовления контактных щеток и токосъемников для различных электрических машин электромобили и мостовые краны с тележкой, мощные реостаты и другие устройства, где требуется надежный мобильный электрический контакт для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических кораблей.
Графит — До
| Молекулярная масса | 12,01 г / моль |
| Происхождение названия | от древнегреческого. — пиши, пиши |
| Статус IMA | действителен, впервые описан до 1959 г. (до IMA) |