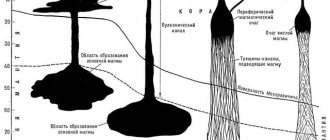
Меловой период, начавшийся 145 миллионов лет назад, назван так по имени горной породы, основные запасы которой сформировались в течение этого времени. Будучи свидетелем минувших эпох, природный мел, свойства, происхождение и применение которого давно известны, воспринимается уже не просто как привычный с детства предмет, а как полезное ископаемое, несущее в себе следы сложных геологических преобразований.
Чем полезен мел для человека?
Мел содержит кальций, который очень полезен для нашего организма, ведь он основа костного строения. К тому же мел нормализует содержание железа в крови и очень хорошо влияет на зубную эмаль, предотвращая возникновение кариеса.
Интересные материалы:
Сколько ступеней во Всероссийском физкультурно спортивном комплексе Гто? Сколько ступенек на высоком Хротгаре? Сколько существовала Молодая гвардия? Сколько таджиков? Сколько танков в одной танковой дивизии? Сколько телят приносит корова? Сколько тонн топлива в цистерне? Сколько тонн в жд цистерне? Сколько цветов должен знать ребенок? Сколько туристов посетило Италию в 2022?
Мел
— это мягкая горная порода, которую легко истереть в порошок. Мел используется в качестве белого пигмента в лакокрасочной и резиновой промышленности, в производстве портландцемента, как пишущий материал.
Известняк
обладает большей твёрдостью: издавна его использовали как материал для каменных сооружений. Большинство храмов великокняжеской Москвы было построено из мячковского известняка, который добывали у села Мячково на Москве-реке и на специальных судах доставляли к месту постройки. Недаром Москву в старину называли белокаменной. В настоящее время известняк служит ценным материалом при производстве цемента, в металлургии в качестве флюса (флюсом в металлургии называют вещества, вводимые в шихту для связывания примесей, например Р2О5, SiO2, в легкоплавкие шлаки,) и в химической промышленности при производстве соды, хлорной извести, карбида кальция.
Мел и известняк — это осадочные горные породы, образовавшиеся из остатков панцирей живых организмов (в первую очередь древних простейших — радиолярий и фораминифер).
Успенский собор на Городке. Звенигород. Около 1399 г.
Белокаменная резьба Успенского собора на Городке.
Мрамор
— метаморфическая горная порода, образующаяся при перекристаллизации под давлением осадочных карбонатных пород — главным образом известняков. Он также состоит из кальцита (карбоната кальция), однако, в отличие от мела и известняка, это крупнокристаллический материал: на сколе
куска мрамора хорошо заметна его зернистая структура. По сравнению с мелом и известняком мрамор твёрд: недаром древние строили из него храмы. Благодаря различным примесям мрамор часто бывает окрашен, мрамор некоторых месторождений имеет красивую структуру, в которой чередуются слои разной окраски. В древности особенно ценились белоснежный каррарский
мрамор, розовый
паросский,
жёлтый
сиенский.
Главный храм афинского акрополя — знаменитый Парфенон построен из блоков
пентелийского
мрамора, который добывали в местечке Пентеликон к северо-востоку от Афин. Пентелийский мрамор имеет едва заметный золотистый оттенок, который усиливается, когда смотришь на Парфенон вечером, на закате солнца. В Италии распространённым сортом мрамора является
чипполино
— так называют белый мрамор с мелкими жёлтыми или зелёными прожилками. А вот знаменитый красный
веронский
мрамор (rosso di Verona) — на самом деле известняк коричнево-красного цвета, в котором часто встречаются окаменелости.
Колонны Парфенона. Афины. Середина
Vв. до н. э.
Из чего они состоят
Мел представляет собой осадочную породу и состоит преимущественно из остатков древних морских простейших, содержащих карбонат кальция. Миллионы лет части тел этих организмов накапливались в некоторых местах нашей планеты и в конце концов образовали богатые месторождения и даже целые скальные массивы. Хорошо известны меловые скалы побережья Северного и Балтийского морей, а также пролива Па-де-Кале в Северной Франции, Дании и Южной Англии. Интересно, что наиболее старое из известных названий Англии – Альбион – происходит от древнеиндоевропейского albho – белый. А основанием для такого наименования острова стали именно белые меловые скалы, находящиеся в самом узком месте, отделяющем Англию от материковой Европы.
Отличие извести от мела состоит в том, что под этим термином известна целая группа химических соединений и смесей, общим у которых является наличие в составе кальция. «Базовая» известь – оксид кальция (СаО), который получают путем обжига некоторых осадочных пород, в первую очередь мела и известняка (CaCO 3 , или карбоната кальция). Такая известь называется негашеной. Существует еще несколько разновидностей извести:
- гашеная (Ca(OH) 2), которую получают в результате взаимодействия негашеной извести с водой;
- хлорная (Ca(Cl)OCl) – в просторечии «хлорка», получаемая при химической реакции, в которой участвуют гашеная известь и хлор;
- натровая, представляющая собой смесь двух химических соединений – гидроксида натрия (NaOH) и гашеной извести.
Сравнение
Области применения мела и извести (правильнее будет сказать – известей, так как их несколько) различаются довольно сильно. Все мы знаем ученический мел, который широко используется в школе, но это только одна из его «специальностей». Кроме этого, он нашел применение при производстве высококачественной мелованной бумаги, а также при создании некоторых сортов резины и в пищевой промышленности. Часто мел играет роль наполнителя в различных составах – от лакокрасочной продукции до полимеров (полипропилена и полиэтилена). И, наконец, роднит его с гашеной известью то, что оба эти материала пригодны для побелки стволов деревьев, бордюров, заборов и так далее.
Разные виды извести отличаются довольно сильно, поэтому сферы их применения также отстоят друг от друга далеко. Негашеная известь используется в строительстве и для получения известей других видов. Гашеная известь, кроме побелки, нужна при производстве стройматериалов, известковых сельхозудобрений, дублении кожи. В стоматологии – для дезинфекции зубного канала, а в электротехнике – в качестве состава, позволяющего снизить (где это необходимо) сопротивление почвы при устройстве заземления. И, наконец, даже в пищевой промышленности гашеная известь известна как пищевая добавка Е 526.
Две основные «специальности» хлорной извести – дезинфекция и отбеливание тканей. Если с первой она справляется великолепно, то во втором случае надо быть осторожным и использовать только составы, изготовленные промышленным способом, так как при высокой концентрации состава он просто-напросто «проест» любую ткань. А главным «призванием» натровой извести является поглощение из воздуха углекислого газа. Это свойство незаменимо в противогазах и водолазном снаряжении. Она даже применялась для подобной цели в первых космических кораблях, но позже перешли к более эффективным составам.
Формула карбоната кальция в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула –
Молярная масса равна г/моль.
Физические свойства – белые кристаллы, находится в различных минералах (кальцит – тригональный, арагонит – ромбический).
Практически не растворяется в воде. Произведение растворимости
Является главной составной частью известняка, мрамора, мела.
Плавится без разложения под избыточным давлением углекислого газа.
Химические свойства карбоната кальция
- Не реагирует со щелочами. Разлагается кислотами:
- Взаимодействует с хлоридом аммония при нагревании:
- Переводится в раствор избытком , образуется гидрокарбонат (известный только в растворе), который определяет временную жесткость природных вод:
- Вступает в реакцию с оксидом кремния:
- При прокаливании разлагается:
Получение
Карбонат кальция добывается их полезных ископаемых. Чистый , необходимый для пищевой или фармацевтической промышленности, можно получить из мрамора. Альтернативный способ получения основывается на процессе кальцинации . При этом можно записать химические превращения сопровождающие его:
Применение
В пищевой промышленности карбонат кальция применяется в качестве белого пищевого красителя . Поскольку он входит в состав мела, то применяется для письма. Используется для побелки потолков, покраски стволов деревьев. Также данное вещество находит применение при производстве красок, резины, бытовой химии (зубной пасты), в строительстве (шпаклевки, герметики). Его используют как отбеливающее средство. Можно с уверенностью сказать, что одними из массовых потребителей карбоната кальция являются производители пластмассы, которые используют его в качестве наполнителя и красителя. Еще одна отрасль применения – его использование в очистительных системах.
Примеры решения задач
[td]Понравился сайт? Расскажи друзьям!
ru.solverbook.com
Формула Карбоната кальция структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CCaO3
Химический состав Карбоната кальция
Символ Элемент Атомный вес Число атомов Процент массы
| C | Углерод | 12,011 | 1 | 12% |
| Ca | Кальций | 40,08 | 1 | 40% |
| O | Кислород | 15,999 | 3 | 48% |
Молекулярная масса: 100,088
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей. Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — ещё один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви. Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространенной. Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
Геология
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит). Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в-основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор). В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция: CaO + h3O → Ca(OH)2 Ca(OH)2 + CO2 → CaCO3 + h3O
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению: CaCO3 → CaO + CO2. В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2: CaCO3 + CO2 + h3O → Ca(HCO3)2. Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту. При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II) CaCO3 + 4C → CaC2 + 3CO.
formula-info.ru
Состав
В состав меловых отложений входят:
- Фрагменты скелетов
– примерно 10%. Это останки не только простейших, но и крупных многоклеточных животных. - Раковины древних моллюсков
– 10 %. Среди них были животные с известняковыми панцирями – фораминиферы. - Частички известкового нароста водорослей
– не более 40%. Большая часть известняковых отложений, вопреки распространенному мнению, образовалась из остатков простейших растений – кокколитофорид, а не благодаря раковинам фораминиферов. Кокколитофориды не вымерли, они прекрасно чувствуют себя на просторах мирового океана и сегодня, принимая участие в обмене углерода между океаном и атмосферой. - Измельченный кристаллический кальцит
– не более 50%. Это природные минеральные образования сложного происхождения. - Нерастворимые силикаты
– до 3%. Это минералы геологического происхождения – песок, осколки горных пород, заносимые в меловые отложения ветром и водой.Свойства мела
Большое влияние на свойства мела имеет влажность, воздействующая на его прочность и пластичность. Повышение влажности приводит к деформации, тогда как в сухой среде мел может рассыпаться даже от незначительного давления.
Насыщенная влагой порода прилипает к строительным инструментам. Именно поэтому строительные работы с использованием карбоната кальция проводят в странах с жарким и засушливым климатом. Прекрасным примером древней постройки из известняка является египетская пирамида Хеопса (Хуфу).
При минусовой температуре порода склонна к распаду на фрагменты в несколько миллиметров.
Таблица
Теперь можно дать ясный ответ на вопрос, в чем разница между известью и мелом. В приведенной ниже таблице подытожено, что у этих материалов общего и чем они различаются.
| Известь | Мел | |
| Что собой представляет | Группа химических соединений и смесей, имеющих в составе кальций. Состоит из:
| Осадочная порода, образовавшаяся из остатков древних простейших организмов |
| Область применения |
| Производство мелованной бумаги, в качестве ученического мела в школе, в качестве дешевого наполнителя при производстве полимеров и лаков, а также в пищевой промышленности и для побелки деревьев, бордюров и так далее |