КАДМИЙ
(Cadmium) Cd, – химический элемент II группы Периодической системы. Атомный номер 48, относительная атомная масса 112,41. Природный кадмий состоит из восьми стабильных изотопов: 106Cd (1,22%), 108Cd (0,88%), 110Cd (12,39%), 111Cd (12,75%), 112Cd (24,07%), 113Cd (12,26%), 114Cd (28,85%) и 116Cd (7,58%). Степень окисления +2, редко +1.
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Кадмий был открыт в 1817 немецким химиком Фридрихом Штромейером (Stromeyer Friedrich) (1776–1835).
При проверке оксида цинка, вырабатываемого одной из шенебекских фабрик, появилось подозрение, что он содержит примесь мышьяка. При растворении препарата в кислоте и пропускании через раствор сероводорода выпадал желтый осадок, похожий на сульфиды мышьяка, однако более тщательная проверка показала, что этого элемента нет. Для окончательного заключения образец подозрительного оксида цинка и другие цинковые препараты (в том числе карбонат цинка) с этой же фабрики послали Фридриху Штромейеру, занимавшему с 1802 кафедру химии в Геттингенском университете и должность генерального инспектора ганноверских аптек.
Также по теме:
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Прокалив карбонат цинка, Штромейер получил оксид, но не белый, как это должно было быть, а желтоватый. Он предположил, что окраска вызвана примесью железа, однако оказалось, что железа нет. Штромейер полностью проанализировал цинковые препараты и установил, что желтая окраска появилась благодаря новому элементу. Он получил название в честь цинковой руды, в которой был найден: греческое слово kadmeia, «кадмиевая земля» – древнее название смитсонита ZnCO3. Это слово, по преданию, происходит от имени финикийца Кадма, который будто бы первым нашел цинковый камень и подметил его способность придавать меди (при выплавке ее из руды) золотистый цвет. Так же звали героя древнегреческой мифологии: по одной из легенд, Кадм победил в тяжелом поединке Дракона и на его землях построил крепость Кадмею, вокруг которой затем вырос семивратный город Фивы.
Бдительный аптекарь
История началась в Магдебурге с окружного врача-инспектора. Он приказал изъять из продажи препараты с оксидом цинка — якобы, там содержится мышьяк. Аптекари возмутились, обратились к Ф. Штромейеру — главному инспектору по аптекам.
Элементарный кадмий
Препараты исследовали, мышьяка не нашли. Зато обнаружили оксид нового элемента. Штромейер назвал открытый элемент «кадмий», в честь героя древнегреческого мифа.
История открытия
«Отцами» элемента в историю науки вошли немецкие аптекари и химик Фридрих Штромейер.
В 1817 году провизоры, исследуя оксид цинка, усмотрели в его составе характеристики, присущие мышьяку. Штромейер провел по их просьбе цикл реакций. Конечным продуктом оказался не мышьяк, а новый серебристый металл.
Его окрестили кадмием – по названию местной цинкосодержащей руды.
Кадм – персонаж древнегреческой мифологии, легендарный основатель и царь Фив.
Свойства Кадмия
Кадмий относится к переходным металлам. Он мягкий, тягучий и ковкий.
Характеристики:
- Кристаллическая структура решетки гексагональная.
- У элемента рекордная для металлов теплопроводность в области абсолютного нуля.
- Цвет белый, серебристый.
Кадмий тяжелый металл, наряду с осмием, свинцом, молибденом.
Имеет три модификации; отличить их можно некоторым физическим параметрам.
Химические свойства:
- Оксиды и сульфиды кадмия почти не растворяются в воде.
- В условиях влажного воздуха на поверхности образуется оксидная пленка. Она препятствует дальнейшему окислению.
- Не образует карбидов.
- В нагретых разбавленных H2SO4 и HNO3 (формулы серной и соляной кислот) кадмий растворяется с выделением водорода.
| Свойства атома | |
| Название, символ, номер | Ка́дмий / Cadmium (Cd), 48 |
| Атомная масса (молярная масса) | 112,411(8)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 |
| Радиус атома | 154 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+2e) 97 пм |
| Электроотрицательность | 1,69 (шкала Полинга) |
| Электродный потенциал | −0,403[2] |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 867,2 (8,99) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,65 г/см³ |
| Температура плавления | 594,1 K (321 °C) |
| Температура кипения | 1038 K (764,85 °C) |
| Уд. теплота плавления | 6,11 кДж/моль |
| Уд. теплота испарения | 59,1 кДж/моль |
| Молярная теплоёмкость | 26,0[2] Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,979 c=5,618 Å |
| Отношение c/a | 1,886 |
| Температура Дебая | 209 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 96,9 Вт/(м·К) |
| Номер CAS | 7440-43-9 |
Рекомендуем: АЛЮМИНИЙ — дороги, которые он выбирает
Биологическое воздействие
Микродозы кадмия есть в биологических организмах: вещество содействует метаболизму.
Токсичность
Однако металл, его растворимые соединения токсичны:
- Наиболее ядовиты пары, запыленный, задымленный воздух.
- Вещество накапливается человеческим организмом, растениями, грибами.
- Тяжелый металл, его соединения провоцируют онкологию, угнетают работу гормональной, кровеносной, центральной нервной систем. Разрушаются кости.
По действию на организм напоминает ртуть, цинк, но токсичность вдвое-втрое превышает цинковую.
Кадмий классифицирован как вещество 2-го класса опасности. 7,50 г металла в кубометре воздуха убивают за двадцать секунд.
Нормы
Наличие металла в воде, продуктах питания регулируется санитарными стандартами РФ (мкг/кг):
- говядина, свинина – 16;
- хлеб – 30;
- рис – 60;
- рыба – 200;
- какао – 500;
- субпродукты – 1000.
Литр питьевой воды не может содержать более 0,001 мг кадмия.
Как производят
Производство связано с получением цинка. Кадмий является побочным продуктом извлечения цинка из его минералов. Этот способ получения амальгамный.
Гидроэлектрометаллургический способ состоит из стадий:
- выщелачивание руды;
- очистка раствора от примесей;
- цементация или электролитическое осаждение металла;
- плавка полученной губки.
Далее при надобности металл рафинируют, доводят до высокой чистоты.
Технология получения
- Кадмий добывают из цинковых руд. Металл извлекают из побочных продуктов. Здесь он аккумулируется во время переработки руды.
- Второй способ получения – из медно-свинцовой пыли. На пыль воздействуют серной кислотой, затем водой выщелачивают сульфид кадмия. Чистый металл получают электролизом либо восстанавливая цинком.
Плюсы и минусы
| Достоинства кадмированных изделий | Недостатки |
| Отлично проявляют себя в среде, содержащей Cl (например, морской воде) | Бесполезно кадмировать изделия, работающие в присутствии серы и ее соединений |
| Обладают высокой пластичностью | Сварка разрушает кадмиевые покрытия |
| Допускается сопряжение с оксидированным алюминием и цинком | Кадмий и его соединения опасны для здоровья |
Нахождение в природе
Кадмиевых месторождений на планете не найдено: редкий элемент рассеян в толще земной коры, воде, воздухе.
Тонна земной коры содержит 130 мг кадмия, литр морской воды – 0,00011 мг.
Вторая форма нахождения металла в природе – шесть собственных минералов.
Чаще кадмий сопровождает другие минералы (полсотни). Так его и добывают – попутно с другими рудами. Особенно богаты цинковые (здесь кадмий есть всегда), свинцовые, медные залежи.
Применение
Большая часть кадмиевых покрытий применяется для защиты:
- изделий, эксплуатируемых в морской воде;
- деталей машин, которые работают в условиях высокой влажности;
- защищают электрические контакты от коррозии.
Важно: применение кадмиевых покрытий в изделиях домашнего обихода запрещено из-за высокой токсичности металла.
Много произведенного кадмия используют в сплавах легкоплавких, антифрикционных, в сплавах с драгоценными металлами.
Пятая часть добытого металла применяется в батареях и аккумуляторах.
Атомная промышленность применяет кадмий для производства регулирующих стержней. Входит в состав экранов защиты от нейтронного излучения.
Рекомендуем: ЗОЛОТО — дар или проклятие человечеству
На подъеме производство солнечных батарей с CdTe.
Часть металла идет на производство красящих пигментов.
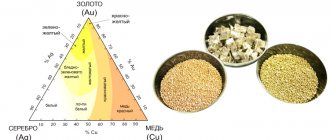
В ювелирном производстве используют сплавы с золотом. В зависимости от процентного содержания составляющих они имеют цвета от ярко-желтого до зеленоватого.
Радиоактивные изотопы используют в лечении онкологических болезней.
Важно: токсичный кадмий может содержаться в оловянных солдатиках, которыми играют дети.
Где используется
Токсичность ограничивает, но не обнуляет достоинства металла. Его используют во всех сегментах, кроме пищепрома.
Промышленность
Здесь нашлось применение металлу как самостоятельной единице и компонента сплавов:
- Антикоррозийные покрытия. Кадмирование обеспечивает самое прочное, цепкое соединение с основой. Применяется в экстремальных условиях: морская вода, тропики, щелочная среда.
- Производство батарей, аккумуляторов для ракет.
- Легирующая добавка к сплавам. Сплавы с кадмием пластичны, стойки к износу. Из них делают провода для линий электропередач, припои, подшипники для начинки морских и воздушных лайнеров. Сплавы используются при пайке стекла, металла, в огнетушителях.
- Компонент полупроводников, пленок солнечных батарей.
Соли металла становятся пигментами (желтый цвет). Но это приветствуется не всегда.
Coca-Cola изъяла с рынка США более 20 тысяч стаканов со своим логотипом. Причина – наличие кадмия в составе краски.
Важнейшая сфера применения – атомный комплекс:
- Кадмиевые стержни регулируют работу реактора.
- Из него состоят экраны, отсекающие нейтронное излучение.
В лабораториях металл используется как реактив.
Другие отрасли
Хорошая теплопроводность в условиях запредельно низких температур сделала металл незаменимым в криотехнике.
Ювелиры добавляют кадмий к золоту, чтобы получить зеленоватые оттенки.
Полезное свойство вещества аккумулироваться раковыми клетками используется в противоопухолевой терапии.
Ежегодное глобальное производство металла исчисляется 20 тысячами тонн.
Цена тонны кадмия на мировых рынках – $2,8-2,9 тыс.
Ограничения
Согласно Техническому регламенту Евразийского экономического союза и директиве Евросоюза, в изделиях сегмента электротехники и радиоэлектроники должно быть не более 0,01 % массовой доли кадмия.
[править] Литература
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3
- Р. Рипан, И. Чертяну. Неорганическая химия: Химия металлов: В 2 т. — М .: Изд. «Мир», 1971. — Т. 1. — 561 с.
- Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., Испр. / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; Под ред. Р. А. Лидин. — М.: Химия, 2000. 480 с .: ил. — ISBN 5-7245-1163-0.
Электрохимический ряд активности металлов
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2
,W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
| Периодическая система химических элементов Д. И. Менделеева | |||||||||||||||||||||||||||||||
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Суперактиноиды | Переходные металлы | Другие металлы | Полуметаллы | Другие неметаллы | Галогены | Благородные газы | Свойства неизвестны |
Чем опасен для человека?
Теплопроводность меди
Люди отравляются кадмием, употребляя воду и зерновые, овощи, растущие на землях, расположенных вблизи от нефтеперегонных заводов и металлургических предприятий. Появляются невыносимая боль в мышцах, непроизвольные переломы костей (кадмий способен вымывать кальций из организма), деформация скелета, нарушения функций легких, почек и других органов. Излишек кадмия может вызывать злокачественные опухоли.
Канцерогенное действие никотина, находящегося в табачном дыме, как правило, связано с присутствием кадмия.
Выделяется кадмий с калом и мочой, но не более 48 мг в день. Больше всего он накапливается в печени и почках, немного — в крови.
Чем больше развита промышленность в стране, тем больше, к сожалению, концентрация этого элемента в почве. В присутствии суперфосфатов растения усваивают кадмий в больших количествах, а если суперфосфатов мало, то кадмий может не усваиваться или усваиваться в минимальных количествах.
Ссылки Править
Периодическая система элементов
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Что такое сила трения в физике Выделить Кадмий и найти в: |
|
- Страница 0 — краткая статья
- Страница — энциклопедическая статья
- Разное — на страницах: , , ,
Изотопы
Природный кадмиум состоит из 6 устойчивых изотопов. Было выявлено 27 устойчивых радиоизотопов: Cd-113 с периодом полураспада 7,7 квадриллионов лет, Cd-109 с периодом полураспада 462,6 дней и Cd-115 с периодом полураспада 53,46 часов. Все остальные радиоактивные изотопы имеют период полураспада менее 2,5 часов и большинство из них имеют период полураспада менее 5 минут. Этот элемент имеет 8 метастабильных состояний, самые стойкие из них: Cd-113 (t ½ 14,1 лет), Cd-115 (t ½ 44,6 дней) и Cd-117 (t ½ 3,36 часов).
Изотопы кадмия имеют атомную массу в пределах от 96,935 Дн (Cd-97) к 129,934 Дн (Cd-138). Основной вид распада наиболее распространенного устойчивого изотопа Cd-112 — это захват электрона и его бета-излучения. Продуктом распада к операции является элемент 47 (серебро), а после — элемент 49 (индий).
Общая информация
Простое вещество — кадмий. Мягкий ковкий металл, аллотропных модификаций НЕ мае..Густина 8,65, т-ра плавления 321,1 ° C, т-ра кипения — 766,5 ° C. Кларк К. — 1,35 · 10-35%. Реагирует с кислотами. Растворимые соединения ядовиты. Образует редкие минералы: гринокит CdS (77,7% Cd), отавит CdCO 3, кадмоселит CdSe, монтепонит CdO (87,5% Cd). Входит в виде изоморфной примеси в минералов цинка, особенно в сфалерита. Примесь Cd (тысячные доли%) является в гидротермальных рудах, где он присутствует в Сфалерит, галените и др., Главным образом сульфидных минералах. Повышенное содержание К. до 1,5% характерен для маложелезистого Сфалерит.
Во влажном воздухе покрывается защитной оксидацийного пленкой с CdO, при сильном нагревании сгорает до CdO. Галогенами легко оксидируется к галида. Растворяется в минеральных кислотах, в лугах не растворим. Реагирует с кислородом при нагревании, а также с кислотами.
Примечания
- ↑ Химическая энциклопедия: в 5 томах / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 280. — 671 с. — 100 000 экз.
- . — Описание соединений кадмия, его открытия и т.п.. Дата обращения 16 мая 2010.
- Кадмий // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. III. — ISBN 9965-9746-4-0.
- ВВЭР-1000: физические основы эксплуатации, ядерное топливо, безопасность / А.М.Афров, С.А.Андрушечко, В.Ф. Украинцев и др. — М.: Университетская книга, Логос, 2006. — С. 45.
- . Решение Совета Евразийской экономической комиссии от 18 октября 2016 года N 113. Дата обращения 19 апреля 2022.
- . — Кадмий на сайте «Справочник химика». Дата обращения 16 мая 2010.
- ↑
- . Интерфакс (4 июня 2010). Дата обращения 4 июня 2010.