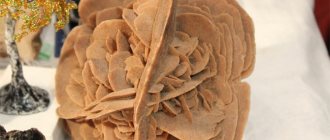
Известен криолит был эскимосам задолго до его открытия европейцами. Название минерала происходит от греческого «криос» — лед и литос — камень (ледяной камень) (д’Андрада, 1800); впервые достоверно изучен Абилгардом (1799).
Английское название минерала — Cryolite
Синонимы: Ледяной камень — Eisstein (Глокер, 1831), орзугизат — Orsugisat — местное обозначение в Гренландии, что означает «жирная соль» (по Хинце); отвечает искусственному α -криолиту.
Криолит
Формула
Na3AlF6
Физические и химические свойства
Хрупкий минерал, кроме белых и бесцветных оттенков, может обладать красно-коричневыми, черными, дымчатыми и черными цветами, при этом блеск их варьируется от маслянистого до перламутрового. Кристаллы выделяются в виде пластинчатых и плотных друз, а также крупнозернистых сплошных масс. В зависимости от происхождения, гидротермального или эндогенного, встречается в близком соседстве с кварцами, амазонитами, галенитами, пиритами, флюоритами, альбитами и сидеритами.
В химическом составе Na3[AlF6] основными элементами выступают: 12,8% — алюминий, 32,8% — натрий, 54,4% — железо. Криолит начинает плавиться при температуре от 1000°С, придавая пламени красно-желтый оттенок. В воде растворяется до 0,037% камня, в кислотах он расщепляется полностью.
Плотность минерала составляет 2,97 г/см³, излом – неровный, раскол – в двух направлениях.
Форма нахождения в природе
Облик кристаллов. Кристаллы псевдотетрагонального и псевдокубического облика, резко преобладают кристаллы, образованные m(110) и с(001) (слагают псевдокубы), реже развиты грани r(110), v(101) и k(101) , которые иногда достигают значительного развития с образованием псевдокубооктаэдров. Редко наблюдаемые кристаллы второй генерации более богаты формами и иногда образуют кристаллы необычного габитуса, уплощенные по (001). На гранях m(110) часто имеется штриховка, параллельная ребрам. Встречаются параллельные ступенчатые сростки кристаллов.
Двойники минерала. Очень распространены двойники; зернистый криолит всегда полисинтетически сдвойникован. Насчитывается не менее 14 законов двойникования, значительная часть которых устанавливается только в зернистом криолите и объясняется, по мнению большинства авторов, воздействием механических напряжении, возникших при охлаждении высокотемпературного кубического β-криолита и при его превращении в моноклинную α-модификацию. Такие двойники воспроизводились экспериментально. В каждом зерне обычно сразу возникают двойники по нескольким законам. Общие геометрические закономерности этого явления рассмотрены многими авторами. Различные двойниковые законы, проявляясь совместно, повышают общую симметрию сростка до ромбической, тетрагональной или кубической. Диагностика различных типов двойников представляет большие методические трудности; указанные различными исследователями законы не всеми приняты. Наблюдались следующие виды двойников (по Дана, 1951):
- двойниковая ось [110], вращение на 90°. Двойники срастания и прорастания обычны, иногда четверники. Двойникование по этому закону очень характерно для крупнозернистого минерала (так называемый «закон Баумхауэра»);
- двойниковая ось [110], вращение на 180°; повторные двойники наблюдаются в зернистом минерале, у отдельных кристаллов менее обычны. Искусственно получены при охлаждении нагретого камня;
- двойниковая ось [021], вращение на 120°; поверхность срастания неправильная. Искусственно получены при охлаждении нагретого минерала. В виде тонких пластинок обычны в зернистом криолите (так называемый «новый закон» Бёггильда);
- двойниковая ось [111], вращение на 180°; ромбическое сечение близко к (110). Двойники повторного типа. Редки, встречены только на кристаллах, в зернистом криолите неизвестны;
- двойниковая ось [100], вращение на 180°, плоскость срастания (001); встречены только в зернистом криолите, для которого обычны;
- по (100), поворот на 180° вокруг [001], плоскость срастания (100); встречены только в зернистом криолите; тонкие пластинки; обычны;
- двойниковая плоскость и плоскость срастания (112); встречены только в зернистом минерале; пластинки; обычны;
- двойниковая плоскость и плоскость срастания (112); встречены только в зернистом минерале; пластинки; обычны;
- двойниковая плоскость и плоскость срастания (110); пластинки; встречены только в крупнозернистом криолите с Урала;
- двойниковая ось [111], вращение на 180°; ромбическое сечение не является возможной гранью, но близко к (110); не были установлены Бёггильдом, но возможно, что это «закон d» Кроса и Хилебранда; встречаются только в зернистом криолите;
- но (211); один из новых законов Падурова; по-видимому, очень редки;
- двойниковая ось [001], вращение на 90°; очень близки к 9;
- двойниковая ось [201], вращение на 120°; очень близки к 8;
- двойниковая ось [201], вращение на 120°; очень близки к 7.
Для кристаллов-двойников наиболее обычен закон 1-й, менее 2-й и 4-й. Двойники по другим законам встречены только в зернистом камне. По-видимому, существуют эпитаксические срастания между высокотемпературным кубическим p-криолитом и криолитионитом; ориентировка минералов в сростках не установлена. Искусственно получены эпитаксические срастания с тенардитом.
Агрегаты. Зернистые выделения, отдельные зерна, кристаллы, фарфоровидные выделения в смеси с опалом.
Месторождения минерала
В природе существует не так много мест, богатых скоплениями криолита. В промышленных масштабах его добывают лишь в одной точке мира – шахтерское поселение Ивиттуут, расположенное в Западной части Гренландии. Массовыми залежами высококачественного криолита славятся земли Новой Зеландии. Единичные месторождения криолита располагаются в Германии, США. Канаде, Намибии, Нигерии и Украине.
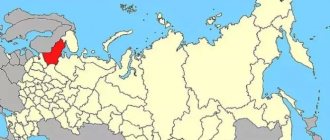
В России, по сравнению с показателем потребности, объемы добываемого криолита предельно малы. Скопления минерала встречаются в Мурманской области, на Южном Урале в окрестностях Ильменских гор, а также в юго-западной области Приморского края.
Химический состав
Химический теоретический состав: Na — 32,86; Аl — 12,84; F — 54,30%. Химических анализов криолита, вполне отвечающих современным требованиям, не имеется; пределы колебаний в составе и возможность изоморфного вхождения различных элементов в кристаллическую решетку минерала не установлены. Большинство анализов обнаруживают несоответствие между количеством катионов и анионов. Чаще устанавливается недостаток F, реже — его избыток. Отношение Na : Аl никогда не отвечает теоретическому и в большинстве анализов составляет от 2,92 до 2,99 (на 0,36 — 0,04 вес.% Na ниже теоретического). Эти результаты, вероятно, вызваны несовершенством методов анализа. Особенно велики расхождения между теоретическим составом и анализами синтетического и природного минерала, выполненными при проведении различных физико-химических и технологических исследований. Были предложены различные варианты формулы криолита. Возможен изоморфизм между высокотемпературным β -криолитом и изоструктурными соединениями K3AlF6 и эльпасолитом (K2NaAlF6); в криолите из Ильменских гор методом пламенной фотометрии обнаружено 0,08% К, а в криолите из Тувы — 0,0028 Li2O,» 0,0008 Rb2O и 0,0008 Cs2O, 0,07% К, 0,007 Li2O, 0,0003 Rb2O, Сене обнаружен. Нередко отмечаемый Са, вероятно, обязан присутствию примеси других минералов, хотя Нёльнер и Лемберг предполагали изоморфное замещение натрия кальцием. Часто отмечаемые в минерале Si, Mg обязаны примеси других минералов, повышенные количества Li — присутствию криолитионита.
Кристаллографическая характеристика
Сингония. Моноклинная. L2PC
Класс симметрии. Призматический — 2/m. тношение Осей. 0,973 : 1 : 1,391; р=90°11′.
Кристаллическая структура
В структуре криолита дискретные, слегка деформированные октаэдры AlF6 находятся в вершинах и в центре элементарной кубической ячейки. Между ними расположены атомы Na, из которых 1/3 имеют координацию 6, а 2/3 — 12. Октаэдры NaF6 находятся на серединах вертикальных ребер и в центрах базальных плоскостей элементарной ячейки, имеют общие грани с кубооктаэдрами, занимающими промежутки между октаэдрами AlF6 и NaF6, в центрах которых располагаются остальные 2/3 атомов Na. В другой интерпретации структура криолита состоит из цепочечных групп NaAlF6, параллельных оси с, с каналами, в которых находятся группы NaF.
Расстояния между атомами в AlF6 -октаэдрах Аl — F= 1,79 — 1,83; в NaF6-октаэдрах Na — F = 2,42 — 2,32; для других атомов Na расстояние Na — F составляет от 2,21 до 2,68 А (Нарай-Сабо и Сасвари).
Высокотемпературный β-криолит— кубический. Cтруктура типа (NH4)3AlF6, близка к структуре эльпасолита. При охлаждении из-за недостаточной величины ионов Na, расположенных в центрах кубооктаэдров, структура превращается в моноклинную — изменяется наклон полиэдров, появляются различия в длине их ребер. Плоскость (110) моноклинного α-Na3AlF6 — криолита соответствует плоскости псевдокуба, очень близкого по размерам к ячейке эльпасолита и (NH4)3AlF6. При полиморфном превращении образуется несколько систем полисинтетических двойников.
Искусственный криолит
Редкость криолита природного происхождения и широкая потребность этого минерала в промышленных отраслях заставили представителей отечественной науки задуматься над изготовлением искусственного аналога.
Первые попытки российские ученые осуществили в 1924 году, и уже через 9 лет в окрестностях Свердловска был открыт первый производственный комбинат.
Синтетический криолит производят несколькими способами:
- с использованием флюоритового сырья;
- путем соединения фторита натрия и алюминия;
- под влиянием плавиковой кислоты на присутствующий в соде гидроксид алюминия.
Криолит производится в виде мелкодисперсного порошка, цвет которого варьируется от бледно-розового до серо-белого. Он опасен для здоровья человека, поэтому при контакте с ним следует использовать средства защиты. Отдельные требования предъявляются к его хранению и транспортировке, для чего используется специальная одноразовая тара – мягкие контейнеры или специальные многослойные мешки. Материал устойчив к возгоранию и взрывам, однако под воздействием высоких температур может выделять токсины.
Сфера и область применения
Как не странно, этот минерал очень востребован в промышленности, а иногда просто незаменим. Но в связи с тем, что этот натуральный камень – большая редкость и в промышленных объемах практически не добывается, возникла необходимость в создании его синтетического аналога. Именно Советский Союз стал первооткрывателем в этой сфере и уже в первой половине 20 века на территории Свердловской области был открыт комбинат по производству искусственного криолита.
По знаку Зодиака
Криолит считается камнем Овнов, Дев, Козерогов и Водолеев. Он остужает их пыл, контролирует эмоциональный настрой, заставляет их быть сдержанными и внимательными. Люди, рожденные под этими знаками, обязательно должны иметь при себе что-нибудь с Криолитом. Причем оправа для камня никакой роли не играет. Более слабое воздействие он оказывает на Стрельцов и Львов, но все равно им рекомендуют носить ювелирные изделия из этого минерала. Кому точно не подходит этот самоцвет, так это Рыбам. Он делает их полностью инфантильными, вялыми, депрессивными. Для других знаков Зодиака он просто нейтрален.
Лечебные свойства
Особых лечебных свойств у него не выявлено. Но, несомненно, они есть. Так замечено, что наличие в помещении этого камня успокаивает нервы, уменьшает головную боль, стабилизирует сердцебиение, нормализует артериальное давление, снижает тонус мышц и поднимает настроение. Он также благоприятно действует на показания организма, оказывает положительное влияние на работу желудочно-кишечного тракта, излечивает простудные заболевания на ранней стадии их развития, укрепляет иммунную систему, помогает избавиться от негативных сновидений. Причем способ отделки на свойства камня не влияет.
Магические свойства
Криолит обладает не настолько сильной аурой, чтобы творить чудеса. Однако, впитанной земной энергии ему хватает для того, чтобы оградить своего хозяина от сглаза и негативного влияния завистников. Если его хранить в доме, то его обойдут стороной кражи. С ним не проводят магические обряды, но его владелец смело может заручиться поддержкой камня на серьезных переговорах, особенно если они касаются расходования внушительных средств. Он не даст нечистым на руку людям обвести вокруг пальца своего хозяина.
Украшения
Несмотря на свою хрупкость, Криолит активно применяется для создания ювелирных украшений. Но не все экземпляры могут быть задействованы, а только те, кто имеет однородный цвет и значительные размеры. Есть много вариантов, как носить этот камень. Из него изготавливают перстни, колье, ожерелья, кольца, подвески, кулоны, браслеты и многое другое. Такую красоту используют и в знаменитых брендах. Криолит прекрасно сочетается с другими камнями.
Бытовое использование
Как не странно, но Криолит используется в различных сферах. Например, он является неотъемлемой составляющей процесса получения алюминия путем электролиза. В связи с нехваткой этого самоцвета, добываемого естественным путем, его стали искусственно выращивать в больших количествах. Криолит-расплав часто используется для получения стекол, эмалей и кислот. Причем применение самоцвета придает стеклам большую стойкость и прочность. Благодаря Криолиту были созданы ударопрочные матовые стекла. Что касается эмалевой промышленности, то этот камень выполняет функцию наполнителя и функцию абразива.
Чтобы создать искусственный Криолит, необходимо иметь флюоритовый продукт. А его количество на земле просто зашкаливает, поэтому недостатка в сырье не будет. Из криолитового порошка производятся плавиковые кислоты, определенные типы реагентов, пестициды и инсекциды. Пестициды являются незаменимым средством для защиты виноградных лоз, фруктовых деревьев, овощей и декоративных растений от нашествия всевозможных вредителей. Фейерверки также изготавливаются с применением Криолита, что дает возможность им светиться ярко желтым цветом.
Способов производства синтетического Криолита несколько:
- при помощи соединения алюминия и фторита натрия;
- с применением флюоритового вещества;
- посредством влияния кислоты плавиковой на гидроксид алюминия, который присутствует в соде.
Искусственный Криолит имеет вид порошка с бледно-розовым или серо-белым оттенком. Его стоимость умеренная. За один мешок весом в 25 килограмм нужно отдать около 3000 рублей. Непосредственный контакт с ним человека может пагубно отразиться на состоянии его организма, поэтому работать с этим камнем необходимо исключительно в средствах индивидуальной защиты.
Существуют определенные требования для его транспортировки и хранения. Для этого применяется тара одноразового использования: либо многослойные мешки специального назначения, либо мягкие контейнеры. Такое вещество плохо воспламеняется и практически не взрывается при попадании в сферу действия высокой температуры, но если процесс возгорания все же пошел, то выделяемые пары очень токсичны и необходимо их опасаться.
Где применяется криолит
За счет ограничения объемов природного криолита в мировых месторождениях, он эффективно заменяется синтетическим аналогом в сферах промышленности. Минерал участвует в производстве алюминиевых сплавов путем электролиза бокситов, в которых под действием расплавленного криолита окись алюминия растворяется наиболее эффективно.
В стекольном деле криолит используют в производстве высокопрочных стекол белого цвета, в химической промышленности – при изготовлении эмалевых составов и плавиковой кислоты.
Уникальные образцы натурального криолита выставляются в коллекциях ювелиров и минералогов.
Искусственный криолит используют в производстве пестицидов, инсектицидов, реагентов и фейерверков.
Использует [ редактировать ]
Расплавленный криолит используется в качестве растворителя для оксида алюминия (Al 2 O 3 ) в процессе Холла – Эру , используемого при рафинировании алюминия . Это снижает температуру плавления расплавленного (жидкого состояния) оксида алюминия с 2000 до 2500 ° C до 900–1000 ° C и увеличивает его проводимость [ цитата необходима
], что делает извлечение алюминия более экономичным. [13]
Криолит используется как инсектицид и пестицид . [14] Он также используется для придания фейерверкам желтого цвета. [15]
Лечебные свойства
Минерал не до конца изучен литотерапевтами, однако замечено, что постоянный контакт с криолитом влияет на психоэмоциональное состояние и некоторые системы жизнедеятельности.
Камень успокаивает нервы, улучшает настроение, нормализует сон, избавляет от кошмаров. Он благоприятно воздействует на иммунную систему и артериальное давление, используется для профилактики и лечения простудных заболеваний на начальной стадии. Замечено также его позитивное воздействие на сердечную, пищеварительную и мышечную систему.
Магические свойства
Криолит с вкраплениями кристаллов сидерита
Криолит не используется эзотериками в различных ритуалах, однако это не значит, что он не имеет магических свойств. Камень обладает энергией Земли и является сильным оберегом от злых духов, зависти, неприятностей, опасностей и роковых случайностей. Талисман с камнем убережет своего владельца от необдуманного решения и финансовых потерь.
Чтобы свойства камня максимально раскрылись, необходимо постоянно держать его при себе и общаться с ним. Талисман или амулет рекомендуется носить в кармане и периодически брать его в руку. Если камень-оберег находится в доме, то ему ежедневно следует уделять немного времени, разговаривать с ним.
Уход за камнем
Криолит – это хрупкий минерал, не устойчивый к внешним воздействиям. Чтобы он сохранил свои эстетические и физические свойства, следует придерживаться основных правил ухода за ним:
- ни в коем случае не хранить камень с другими минералами, для этого нужно использовать отдельную шкатулку с тканевой обивкой;
- не оставлять криолит под прямыми солнечными лучами;
- не допускать попадания на поверхность камня влаги, особенно капель росы и дождя;
- снимать камень во время физических нагрузок;
- для очистки использовать сухую фланелевую салфетку, не использовать средства, содержащие абразивы или кислотные составы.
Рафинирование алюминия
Алюминий, полученный электролизом, называют алюминием-сырцом. В нем содержится металлические и неметаллические примеси, газы. Примеси удаляют рафинированием путем продувки расплава алюминия хлором. Образующийся парообразный хлористый алюминий, проходя через расплавленный металл, обволакивает частички примесей, которые всплывают на поверхность металла и их удаляют. Хлорирование алюминия способствует удалению газов, растворённых в алюминии.
Затем жидкий алюминий выдерживают в ковше при температуре 700 – 730 °С для всплывания неметаллических включений и выделения газов из металла. После рафинирования чистота алюминия составляет 99,5 – 99,8%. Для большинства потребителей алюминия такой чистоты вполне пригоден. Однако, для отдельных отраслей современной техники нужен алюминий более высокой чистоты. Такой алюминий получают электролитическим рафинированием, при котором загрязненный алюминий служит анодом и подвергается растворению и осаждению на катоде, а чистый алюминий является катодом. При таком рафинировании получают алюминий чистотой 99,996%.
При необходимости получить алюминий более высокой чистоты применяют метод зонной плавки или дистилляции алюминия.
При зонной плавки из алюминия электролитического рафинирования отливают прутки и помещают в кварцевую трубку, в которой создают вакуум. Вокруг трубки располагают индуктор, соединенный с источником электрического тока высокой частоты (ТВЧ). Под индуктором пруток расплавляется и возникает зона жидкого алюминия, а остальная часть прутка остается твердой. Индуктор передвигается вдоль прутка с определенной скоростью и зона жидкого алюминия перемещается. При этом примеси концентрируются в расплаве и вместе с ним передвигаются к концу слитка. Затем слиток извлекают и конец отрезают. Оставшаяся часть состоит из алюминия высокой чистоты (99,9999%).
При применении способа дистилляции алюминия рафинирование его осуществляется через так называемые субсоединения путем пропускания парообразных хлористого и фтористого алюминия над расплавленным алюминием при температуре 1000 °С и выше.
Эти субсоединения при охлаждении разлагаются на алюминий и хлористый или фтористый алюминий. Примеси, содержащиеся в черновом алюминии, не перегоняются. Этим способом получают алюминий очень большой чистоты (99,99999%).
Последние два метода рафинирования дороги и малопроизводительны. Они используются для очистки лишь небольшого количества металла, необходимого для изготовления полупроводников и других ответственных изделий.
Подробнее: Рафинирование алюминия
Знак зодиака
В астрологии криолит мало изучен. Выбирать его в качестве талисмана следует представителям зодиакальной системы, обладающим вспыльчивым и взрывным характером.
Криолит рекомендуется постоянно иметь при себе Козерогам, Водолеям, Овнам и Девам. Их самоцвет научит контролировать свои эмоции, сделает сдержаннее по отношению к себе и окружающим.
Не так сильно выражено влияние камня на Львов и Стрельцов. Не подходит минерал Рыбам, так как усиливает их склонность к инфантильности и депрессивному настроению.
К остальным знакам Зодиака камень относится нейтрально. Им рекомендуется при выборе криолита полагаться исключительно на внутреннее чутье и симпатию.
История
Происхождение названия камня таково. В конце 18 века на территории Гренландии был найден достаточно большой осколок камня, очень похожий на глыбу льда. Им заинтересовался ученый-натуралист из Дании Петер Христиан Абильдгор. Именно он полностью его исследовал и дал исчерпывающее описание. Красота находки была настолько изумительной и впечатляющей, что натуралист дал ему название «Ледяной камень» или «Морозный камень» от двух греческих слов «криос», что в переводе означает «лед» и «литос» — «камень». Годом его открытия принято считать 1799 год.