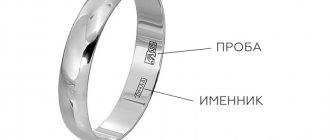
Когда возникает необходимость проверки золота на подлинность
Есть множество ситуаций, когда приходится в домашних условиях устанавливать, видим ли перед глазами натуральное золото или подделанный металл. Подделки под золото часто выглядят как натуральный металл и представляют собой сплав из нескольких элементов. Для этих целей используют латунь, алюминий, железо. Используются сплавы: вермей, пинчбек, батбронза. Иногда, это просто хорошо отполированная медь. Другой вариант, когда можно говорить о том, что драгоценный металл не является подлинным – использование золота более низкой пробы, чем заявленная.
Наряду с профессиональными способами проверки с использованием специальных химических реактивов и пробирных камней, а также современных приборов-анализаторов, есть множество народных вариантов.
Умельцы придумывают все новые и новые методы тестирования благородного материала на подлинность. Известны варианты идентификации с использованием уксуса, магнита, ляписного карандаша. Один из самых достоверных, надежных способов: проверить золото йодом в домашних условиях. Объяснение этому: йод – это редкий химический элемент, который способен вступить в реакцию с таким инертным элементом, каким является золото.
Приобретаем и используем химические реактивы, стандартные образцы и другие запасы для лаборатории
Содержание
Приобретение и входной контроль Учет и идентификация Хранение реактивов и стандартных образцов
Лаборатория должна располагать ресурсами, необходимыми для управления лабораторной деятельностью и для ее осуществления. Такие ресурсы, в частности химические реактивы, стандартные образцы и другие запасы, приобретенные для обеспечения испытаний, нуждаются в соответствующем контроле, учете и хранении с целью исключения при использовании отрицательного влияния на качество испытаний.
Приобретение и входной контроль
Приобретение химических реактивов, стандартных образцов и других запасов (далее — материалов) для целей испытаний продукции осуществляется лабораторий по заявкам
(форму заявки устанавливает лаборатория).
Приобретенные материалы должны соответствовать требованиям соответствующих нормативных документов и иметь необходимые сопроводительные документы (паспорт изготовителя, сертификат соответствия, гигиенический сертификат и другие документы).
Персонал лаборатории проводит входной контроль
сопроводительной документации и материалов. После проведения анализа сопроводительных документов и их технического содержания принимают решение об одобрении материалов к использованию.
Далее персонал лаборатории:
- сверяет полученные материалы со счетом или спецификацией на приобретение;
- проверяет целостность упаковки и наличие необходимой документации (паспорт, сертификат, удостоверение качества, инструкция);
- регистрирует поступивший реактив в журнале учёта химических реактивов (форму журнала устанавливает лаборатория);
- определяет место хранения.
Вернуться к содержанию
Учет и идентификация
В журнале учёта химических реактивов отражаются следующие данные:
- название реактива;
- нормативный документ, по которому изготовлен реактив;
- дата прихода реактива;
- количество;
- дата изготовления;
- срок годности;
- подпись сотрудника, принявшего реактив, с расшифровкой (если журнал ведётся в электронном виде, то подпись сотрудника не требуется).
Каждую ёмкость с поступившим химическим реактивом идентифицируют с присвоением номера согласно перечню химических реактивов.
В случае, если на ёмкости с поступившим химическим реактивом отсутствует этикетка завода-изготовителя или поставщика, или химический реактив перефасовывается в другую ёмкость, ёмкость должна снабжаться этикеткой, на которой содержится следующая информация:
- название реактива;
- поставщик;
- степень чистоты;
- дата изготовления;
- содержание вещества;
- химическая формула;
- срок годности;
- номер партии;
- масса нетто;
- нормативная документация на химический реактив.
Вернуться к содержанию
Хранение реактивов и стандартных образцов
Реактивы должны храниться в условиях, предписанных нормативными документами, по которым изготовлен реактив, и в соответствии с методическими рекомендациями по технике безопасности при работе в аналитических лабораториях.
Химические реактивы, используемые в каждодневной работе лаборатории, хранятся в специальных шкафах в помещении лаборатории.
Хранение химических реактивов в шкафах осуществляется согласно перечню химических реактивов, который закрепляют на внутренних сторонах дверей шкафа. Персонал лаборатории должен нести ответственность за своевременное обновление этого перечня.
Расход реактивов, использованных в лаборатории, фиксируется в журнале (форму журнала устанавливает лаборатория).
Хранение приготовленных растворов и стандартных растворов в шкафах осуществляется также согласно перечню приготовленных растворов, который закрепляют на внутренних сторонах дверей шкафа. Персонал лаборатории несет ответственность за своевременное обновление перечня приготовленных растворов и стандартных растворов, находящихся на хранении в лаборатории.
Ёмкости с растворами идентифицируются
с присвоением номера согласно перечню химических реактивов и снабжаются этикетками, которые содержат следующую информацию:
- название химического вещества;
- концентрация раствора;
- нормативная документация на метод;
- дата приготовления;
- срок годности (при наличии такой информации в нормативной документации на метод).
При хранении растворов химических реактивов и стандартных растворов в холодильнике там должен находиться поверенный градусник. Показания градусника ежедневно фиксируются в журнале регистрации температуры
в холодильнике (форму журнала устанавливает лаборатория).
На холодильник вывешивается перечень стандартных растворов и растворов химических реактивов, хранящихся в холодильнике.
Стандартные растворы и растворы химических реактивов, хранящиеся в холодильнике, идентифицируются и маркируются.
Вернуться к содержанию
Ссылка на источник
Блог «Лаборатория_» на Яндекс.Дзен, статья «Приобретаем и используем химические реактивы, стандартные образцы и другие запасы для лаборатории
«.
На сервисе «Материалы» в разделе «Открытая разработка» Вы можете ознакомиться с примером процедуры по управлению запасами
, в разделе «Формы документов» — с готовыми шаблонами
форм записей
для контроля и учета реактивов.
Необходимые инструменты для проверки йодом
В ход идет несложная технология с использованием таких средств, которые найдутся в любом доме. Для проверки понадобятся:
- спиртовой раствор йода, он продается с разной концентрацией. Наиболее распространенный вариант 5%-й раствор йода.
- ватная палочка;
- наждачная бумага;
- этиловый спирт высокой концентрации;
- салфетка из мягкой ткани, такой как фланель.
Для работы не помешают лупа и пинцет, если необходимо проверить мелкие детали.
Йод способен вступить в реакцию с золотом в обычных условиях, оно темнеет на месте нанесения. Образуется — йодид золота — AuI. Темная зона будет иметь разный оттенок. Это зависит от того, какая проба золота: 375, 585 или 750. Последняя дает, соединившись с йодом, зону темно-зеленого цвета, а у золотого материала 585-й пробы получается темно-коричневый оттенок.
Отсутствие реакции – верный признак подделки.
Способ извлечения золота из иодидных растворов
(5 ГОСУДАРСТВЕННЫЙ КОМИТЕТПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМПРИ ГКНТ СССР ПИСАНИЕ ИЗОБРЕТЕНИЯАВТОРСКОМУ СВИДЕТЛЬСТВУ О С: нн сится к гидрометал-,потери зтоллота и иода составляют соотт быть использовановтетствейно 0,2-0,8 и 0,6%;ота и регенерации , » .: длдиотдельность процесса 2,5 — бч;являйобразование отходов (щелочные или с охимический способ слабокислые растворы, содержащие соли одидноготравильнои: калйя, т,е; способ позволяет регенерироменной регенерацией . вать основной компонент травильного раснерастворимыми ано- твора, а не сам раствор),напряжении 4-5 В и Известен также способ извлечения зо . Длительность про- лотаитз раствОровпослетравления элект н извлечения золоте роииих злементрв, содержвитих золото егенерации травите-, . (0,001 — 0,0020 ь) в форме комплексного йодикулярный иод состав- да, путем добавления раствора к сернойФ. Хуляков и др. кислоте в отношении (4-10);1. Полученную ных цветных метал- -;, смесь нагревазют до кипения (150 С) и выс, 449-451);: -:.:.; держиеаЮт прй этой температуре 2 ч до разприсущи следующие, .,: лосжнеинсия иодидногокомплекса, Врезультате реакции выделяется золото, а ссивности кислорода иод возгоняется и оседает на стенках холона аноде, происходит дильника, Затем смесь охлаждают до темперудования (это требу- ратуРы окружающей среды, металлическое соба специальных ма- золото отделяют от раствора. Иод снимают а; СО СТЕНОК ХОЛОДИЛЬНИКа, СТЕПЕНЬ ИЗВЛЕчЕ.(54) СПОСОБ ИЗВЛЕЧЕНИЯ ЗОЛОТА ИЗИОДИДНЫХ РАСТВОРОВ(57) Изобретение относится к гидрометаллургии при регенерации иодистых травильИзобретение атнолургии золота и можедля извлечения золйодидных травителей.Известен электризвлечения золота из иго раствора с одноврейода. Процесс ведут сдами при рН 4 — 12,8,температуре 50 — 600 Сцесса 2.5-6 ч. Степен99,2-99.8%, Степень рля в пересчете на молеляет 99,4% )(см, И»Металлургия вторичлов», М: Металлургия,Данному способунедостатки:из-за высокой агреи иода, образующихсясильная коррозия обоет для реализации спотериалов для электрод 2нйх растворов, В раствор иодистого трави-теля, содержащего 280 мг золота. вводят 18н. раствор гидроксида натрия до рН 12.8,затемприливают 0,75 мл 30-ного растворапероксидаводорода до создания концентрации 1 фг/лс Смесь перемешивают, нагревают до кипения, выдерживают при ипении 0.5 ч, Осадок золота отделяютфильтрацией.Степейь осажденйя золота сосчтавляет 100% с точностьюанализа +0,1%.Ыния золота и иода соответственно 99,9 и90% (см патент Польши М 115387),Способу присущи следующие недостатки:высокая энергоемкость процесса (температура нагревания растворов 150 С. неменее 2 ч);сложность реализации способа (агрессивность элементарного 12 и особенно горячих растворов Н 2804 предьявляют высокие 10требования к аппаратурномуоформлениюспособа):низкая степень регенерации иода 90%;разрушение трэвильного раствора и образование отходов, 15Наиболее близким техническим решением к предлагаемому является способ очист.ки «золота, включающий растворениенеочищенного»золотав иодидном растворе,удаление нерастворимых частйц из:раствора и восстановЪейие золотадо «металлическогопутей доведения рН до величйны неменее 12 (см. Европатент ЕР М 0253783); «К недостаткам способа следует отнестинизкуюстепень извлечения золота 95-98% 25(в растворе остается еще 139-1800 г золота)и длительность процесса»до 80 ч.Цель изобретения — повышение степени извлечения золота и ускорений процесса. 30Поставленная цель достигается в способе извлечения золота из иодидных растворов, вкл юча ю щем обработку растворовгидроксидом щелочного металла при перемешивании с последующим отделением 35осадка золота, тем, чтов отличие отйрототипа гидроксид щелбчного металла вводятдо достижения рН 12,8 и проводят обработку вприсутствии пероксида вбдорода вколичестве 1-20 г/дм при температуре не 40зменее 90 ОС.Известно, что щелочной раствор ибдистого калия восстанавливает золото. Методисйользуется для качественного определения золота, Восстановление золота происходит поуравнениюКАо 4+ ЗКОН =Аи+ 1/2 КОз+7/2 К+3/2 Н 20ЛВ качестве восстановителя выступаетиодид-ион, окисляющийся до йодатэ, По 50данным прототипа й полученййм экспериментальным результЭтэм осэждение золотанеколичественное (92 98%), Возможно зтосвязано с обратимостью реакции (1) или образованием неизвестных соединении золота.Экспериментально установлено, что пероксид водорода в количестве 1-20 г/дмпри рН 12,8 ускоряет процесс выделениязолота, позволяет количественно садить золото из иодистого травителя, при этом практически исключаются потери иода. В предлагаемом способе пероксид водородаиграет роль катализатора. ускоряющегопроцесс (1) восстановления золота иодидионом, Степень осаждения золота не зависит от исходной концентрации пероксидаводорода (не влияет соотношение Н 202:Ао),При увеличении количества пероксида водорода, когда проявляются его восстановительные свойства (25-60 г/л), степеньосаждения золота уменьшается, осадокмелкодисперсный, При рН 12,8 осаждениезолота — неполное,Установлено, что кроме рН и расходапероксида водорода степень осаждения золота зависит от времени и температуры, прикоторой проводят осуществление способа,При комнатной температуре для осаждениязолота требуется 8-40 ч. При температуре90 С полное осаждение золота происходит за 1 ч, включая время нагрева и охлаждения, Влияние перечисленных параметровнэ осаждение золота из иодидного растворапроиллюстрировано в таблице,В результате реализации предлагаемого способа после осаждения золота раствор содержит иодид, иодат и гидроксидщелочного металла. При добавлении к подобному растворуминеральной кислоты (после нейтрализации щелочи) происходитследующее взаймодействие компонентов5 +Оз+6.Н «ф+ ЗН 20(2)Это приводитпо существу к регенерациитравильного раствора,Способ осуществляют следующим образом,В травильнь 1 й раствор при перемешивайиивводят раствор гидроксида щелочного металла до создания рН 12,8, а затемраствор пероксида водорода до созданияего концейтрации 1-20 г/дмз. Нагреваютдо90 яС (или до кипения), Выдерживаютпри этой температуре 30 мин, отстаивают30 мин и фильтруют, Осадок сушат, В фильтрате и осадке определяют концентрациюзолота, РаСсчитывают степень осаждениязолота.В примерах использовался иодидныйтравитель. содержащий, г/дм; иод 20;з,йодид калия 40; хлорид натрия б; золото1,12.П р и м е р 1. В стакан на 350 мл поместили 250 мл иодидного травителя, содержащего 280 мг золота. На рН-метре довелирН 18 н, раствором йэОН до 12,8 и затемприлили 0,72 мл 30%-ного раствора пероксида водорода (до создания концентрацииН 202 — 1 г/дмЗ), перемешали и нагрели докипения, Прокипятили 0,5 ч, отстояли 0,5 ч.30.30юЮ 10,0 5,0 5,0 5,0 5,0 5,0Ц 30 30 30 30 30 30 Кипячение. 30 90 90 22 30 30 95,0 92,0 98,0 303080 ч Отфильтровали осадок золота. В фильтрате золото не обнаружено, В осадке найдено 280 мг золота. Степень осаждения золота 100%.К оставшейся части фильтрата прилили при перемешивании концентрированную соляную кислоту до создания рН 6,8. В фильтрате определили суммарную концеитрацию иода — 49,6 г/дм, Степень регенеразции иода 98%, Определили скорость травления золотой пластинки. В исходном травителе скорость травления — 11,2 мг/см ч, в регенерированном травителе скорость травления — 11 мг/смч.гОстальные приМеры осуществляют аналогично, Сведения об условиях их осуществления и достигаемоМ эффекте приведены в таблице. Примеры 1,3-5, 8, 10, 13. 14 иллюстрируют осуществление способа при использовании всех ириэнаков. указанных в формуле изобретения в заявляемом интервале расхода НгОг, рН и температуры, Примерь 1 2, 6, 9, 15, 16, 17 иллюстрируют результаты эксперимента при осуществлении способа с режимами; отличными от заявляемого интервала, В примерах М 10-12 показано влияние температуры, В примерах М 15-17 показано осаждение золота в соответствии с прототипом. Из-зэ отсутстВлияние рн и расходосаждения золота вия в прототипе более определенных чем рН 12 параметров процесса время, температура) поставлены эксперименты при условиях, близких к заявляемому способу.Таким образом, предложенный способ извлечения золбта из иодидных растворов по сравнению с прототипом, обладает следующими преимуществами:степень извлечения золота увеличивается с 95-98 до 99,9-100%;остаточная концентрация золота в растворе не превышает 1 мг/л; длительность процесса уменьшается в 2-10 раз;в результате реализации Способа не образуются отходы, создаются условия для регенерации травильного раствора,формула и зоб рете н и я Способ извлечения золота из иодидных растворов, включающий обработку растворов гидроксидом щелочного металла при перемешивании с последующим отделением осадка золота, о т л и ч а ю щи й с я тем, что, с целью повышения степени извлечения золота и ускорения процесса, гидроксид щелочного металла вводят до достижения рН 12,8 и проводят обработку в присутствии пероксида водорода в количестве 1-20 г/дм при температуре не менее 90 С. пероксида водорода на степеньиз иодистого травителя-огсзЕу1 Примечаниемин Часть осадка мелкодисперсная Осадок мелкодисперс. ныи
Смотреть
Процедура проверки подлинности золота йодом. Пошаговая инструкция. Видео и фото
Описание метода, как проверить золото в домашних условиях на подлинность йодом. Провести тестирование несложно и безопасно. Вся процедура проходит в несколько стадий.
Подготавливаем йод медицинский и ватные палочки.
Выбираем украшение из золота для проверки
Наносим ватной палочкой каплю йода на украшение
Ждем некоторое время до высыхания
Протираем пятно тряпичной салфеткой
Обработать изделие 585 или 583 пробы медицинским спиртом
На первой стадии подготовки изделие обрабатывают медицинским спиртом. После обработки дают высохнуть.
Рекомендуется для начала очистить украшение с помощью спирта
Ошкурить металл на внутренней стороне
Вторая подготовительная стадия проводится с применением наждачной бумаги. Украшение или просто предмет из золота ошкуривают с той стороны, которая не является «лицевой». Так кольцо обрабатывается с внутренней стороны. Необходимо снять верхний слой металла, поскольку он может быть покрыт пленкой внешних веществ. Необходимо открыть слой золота.
Помимо шкурки можно использовать любой абразивный материал, только не очень грубый, чтобы не снять слишком толстый слой металла и не повредить изделие.
Нанести йод на украшение в протертом месте
На следующей стадии наносится йод ватной палочкой. Можно использовать пипетку, с помощью нее можно капнуть ровно на то место, которое зачищено. Стоит постараться минимизировать площадь, на которую попадает йод. На ней возникнет реакция, произойдет изменение цвета.
Реакция не зависит от того, какой размер пятна, поэтому не стоит стремиться к попаданию большего количества реактива на поверхность.
Наносим йод на очищенную поверхность украшения
Получаем результат
Дальнейшие этапы характеризуются наблюдением за процессом. Возникает химическая реакция с веществом из группы галогенов, к которым относится йод. Проверить золото йодом можно по изменению цвета. Вариации коричневых или темно-зеленых оттенков свидетельствуют не только о том, что в реакции участвует золото, йод указывает на пробу.
Зеленоватые тона характеризуют более низкопробный металл с большим содержанием меди.
Чем можно растворить золото
Долгие годы химики использовали лишь опасный метод, в котором при предельно высокой температуре золото растворяется в реакции с фтором. Но в современном мире применяют новые, более безопасные способы.
Амальгама
Амальгамой называют сплавы ртути в жидком или твердом состоянии, его используют как промышленный метод аффинажа. Процесс амальгамации золота заключается в особенности ртути образовывать соединения нескольких металлов.
Перед амальгамацией следует поместить самородок в раствор азотной кислоты в соотношении с водой 10:1. Золото должно находиться в растворе до полного завершения видимой реакции, после чего его необходимо промыть.
Для амальгамации драгметалл и ртуть берутся в одинаковой пропорции. В неметаллический лоток помещают оба вещества и вращают его. Шарик ртути растворяется в молекулах самородка. Ненужный осадок выливается из лотка.
Насыщенную золотом амальгаму необходимо осторожно промыть под проточной водой.
Излишки ртути из амальгамы удаляются путем продавливания шарика через мокрую замшу. Оставшееся на поверхности соединение нагревается до полного испарения ртути.
Царская водка
Большинство кислот оказывают страшное воздействие на органику. Но даже в них не растворяется золото. Знаменитое изобретение Ломоносова — царская водка — единственная кислота, способная привести в действие реакцию.
Царской водкой называют смесь соляной и азотной кислоты в особом соотношении (1:3). Ее свойства многократно усилены благодаря высокой концентрации компонентов.
Мнение эксперта
Всеволод Козловский
6 лет в ювелирном деле. Знает все о пробах и может определить подделку за 12 секунд
Драгметалл растворяется в царской водке благодаря тому, что азотная кислота окисляет соляную. Образуется особое соединение — атомарный хлор, который мгновенно реагирует с металлом, создавая сложную золотохлористоводородную кислоту. Часть драгметалла кристаллизуется, а другая часть — растворяется.
Стоит отметить, что протекание химической реакции зависит от того, в какой кислоте растворяется металл и какова ее концентрация.
Хлорка
Хлорка, широко применяемая в быту, — это водный раствор газообразного хлора, относящегося к группе галогенов. Для аффинажа хлорка, приобретенная в обычном магазине, не подойдет, т.к. ее концентрация слишком низка.
Концентрированный раствор хлора оказывает следующее действие: хлор распадается на соляную и хлорноватистую кислоты, вторая, в свою очередь, под действием солнечных лучей разлагается на соляную кислоту и кислород. Как и в реакции с царской водкой, выделяется атомарное вещество, которое с легкостью окисляет самородок.
Йод сам по себе — не растворимое в воде вещество. Растворяется его соединение с йодидом калия. Это лекарственный препарат под названием Люголь.
Золото растворяется в Люголе из-за того, что йод создает непрочные соединения — анионы. Но реакция проходит намного медленнее, нежели с кислотами, да и растворяется лишь верхний слой металла.
Какой способ подходит для домашних условий
Аффинаж золота (получение чистого металла) можно произвести и дома. Самый безопасный метод растворения — с помощью электрического тока.
Электролиз
Большая ванна наполняется соляной кислотой и хлорным золотом — реактивом, используемым для апробирования изделий и определения пробы. Его можно выделить при помощи царской водки, золота и аммиака или приобрести в готовом виде в магазинах ювелирного оборудования.
Реакция, называемая электрохимической, протекает за счет напряжения, поданного в ванну. В результате металл высокой пробы без примесей оседает на бортиках, а на дне ванны осадком выпадают оставшиеся компоненты.
Другие средства для проверки
Среди других средств проверки подлинности благородного металла есть также несколько несложных вариантов.
Магнитом
Проверка с помощью магнита. Используется свойство золота быть диамагнетиком. Это вещество, которое не реагирует на магнитное поле. Более того, чистый металл будет отталкивать от себя магнит. Другие же металлы, за исключением драгоценных обладают в той или иной мере свойствами ферромагнетиков, испытывающих с магнитом взаимное притяжение.
Поэтому золото невысоких проб с присадками других металлов может реагировать на магнит. Если же изделие «прилипает» к нему – это признак использования ферромагнитного сплава с железом, никелем, другими металлами.
Таким образом можно определить поддельное украшение или обнаружить более низкую пробу в домашних условиях.
Существует возможность подделок из таких материалов, как медь и алюминий, поскольку они не магнитятся. Однако в присутствии сильного магнита между ним и медью возникает поле, которое срабатывает таким образом, что при приближении к металлу и, почти коснувшись его, магнит резко останавливается.
Золото в чистом виде не притягивается магнитом
Ляписным карандашом
Лекарственное средство на основе нитратов серебра и калия пригодится для тестирования золота. Для этого украшение опускают под воду или смачивают часть его, на влажную площадку наносят полоску карандашом. Затем протирают сухой салфеткой или ватным диском. Оставшийся от ляписа след свидетельствует о поддельности изделия.
На золоте никаких полосок не останется.
Самый распространенный вид ляписного карандаша
Как растворить хлором золото в домашних условиях
Использование хлора в рудном гидрометаллургическом цикле производства золота имеет достаточно длинную историю. С середины и до конца (80-90 годы) XIX столетия хлоринационное выщелачивание золота, основанное на образовании водорастворимого хлорокомплекса AuCl-4 по реакции: 2Au+3Cl2+2Cl-=2AuCl-4,
являлось основным и практически единственным способом гидрометаллургической переработки золотосодержащих руд.
Впервые экспериментальные работы по извлечению золота хлором были проведены Перси, который сделал сообщение о них в 1848 г. Первая заводская хлоринационная установка была создана в 1849 г. в Рейхештейне. В последующие годы в США и Австралии построен ряд заводов по выщелачиванию золота из руд хлором с использованием различных вариантов аппаратурного оформления процесса /1/.
Хлоринацию газообразным хлором, как правило, производили под небольшим давлением в серии последовательно расположенных деревянных перколяционных чанов с плотными освинцованными крышками и ложными днищами, на поверхность которых насыпали слой гравия и песка. Хлор подавали в нижнюю часть чана (под песчаный фильтр) и пропитывали им руду в течение 12—36 ч. После этого чан заполняли водой. Вытесняемый при этом избыточный хлор через выпускную свинцовую трубу в верхней части чана поступал в последующий хлоринационный чан. После пропитывания хлором загрузки последнего чана, избыток его вытеснялся в 1-й чан, и этим цикл хлоринации завершался. Такая систем обеспечивала максимальную степень использования хлора, расход которого при обработке предварительно обожженной (с целью удаления сульфидной серы) руды составлял менее 1% от массы обрабатываемого материала.
Усовершенствованный вариант хлоринации предусматривал использование в качестве основных реакционных аппаратов металлических вращающихся барабанов («бочек»), изготовленных из железа и футерованных изнутри свинцом. Аппараты имели производительность от 12 до 18 т руды и работали в периодическом режиме. Преимуществами данного способа хлоринации, по сравнению с предыдущим, являлись:
— перетирание рудного материала при выщелачивании (что имеет особое значение для удаления с поверхности золотых частиц пленок хлористого серебра);
— возможность работы при более высоком давлении хлора;
— использование вместо газообразного хлора других хлорсодержащих реагентов, в частности, хлорной извести, генерирующей Сl2 в результате взаимодействии Ca(OCl)2 с вводимой в процесс серной кислотой.
Процесс хлоринации в бочках осуществляли следующим образом. Сначала в бочку заливали воду, затем вводили хлорную известь и сверху загружали обожженную руду. После этого на слой руды заливали серную кислоту, и крышку, закрывающую люк, плотно затягивали болтами.
По опыту золотоизвлекательной фабрики «Криппл-Крик» (США) и некоторых других объектов, практикующих данную технологию, расход хлора в процессе «бочечной» хлоринации обожженных золото- и серебросодержащих руд составлял 0,15—0,5% от массы исходной руды.
Наиболее значительного масштаба хлоринационное выщелачивание золота достигнуто на фабрике «Маунт Морган» (Австралия), где этот процесс производили в открытых перколяционных чанах посредством выщелачивания руды хлорной водой. Руду подвергали сухому измельчению в шаровых мельницах до крупности минус 20 меш (0,84 мм) и обжигали во вращающихся цилиндрических печах. Обожженную руду выщелачивали в открытых бетонных чанах прямоугольной формы вместимостью по 100 т. Необходимую для процесса хлорную воду производили из газообразного хлора путем пропускания его через скрубберы с последующим накапливанием хлорной воды в закрывающихся емкостях, откуда затем подавали на орошение руды в открытые чаны-перколяторы. Раствор (с концентрацией хлора 1,4 г/л) заливали в чаны в таком количестве, чтобы уровень его был выше уровня руды. Контакт руды с раствором продолжался в течение 36—64 ч, при расходе хлора 1,3 кг на 1 т руды. Осаждение золота из растворов производили адсорбцией на «фильтрах» из древесного угля по реакции:
4AuCl3 + 3С + 6Н2О = 4Аu + 12НCl + 3СO2
Извлечение золота описанным процессом, в зависимости от характера руды, составляло от 92 до 95%,
Кроме угольной адсорбции, как установлено многочисленными экспериментальными исследованиями, извлечение золота из хлоридных растворов может быть осуществлено и химическими способами с использованием в качестве осадителей металла сульфата железа (П), сернистого газа, а также сероводорода и сульфидов тяжелых металлов (СuS, PbS, FeS). В первых двух вариантах (FeSO4, SO2) золото осаждается в форме металла, в остальных случаях — в виде сульфида Au2S3.
Приведенное выше описание ранее применявшейся гидрохлориционной технологии извлечения золота из руд, естественно, соответствовало техническому уровню производства золота того периода. Однако многие моменты данной технологии не утратили своей актуальности и в настоящее время в связи с вновь возродившимся интересом к использованию хлора в гидрометаллургии золота (о чем будет сказано в последующих разделах статьи).
Кардинальным фактором, определившим судьбу гидрохлоринационного способа извлечения золота, явилось создание (1887—1889) и последующее бурное развитие процесса цианистого выщелачивания. Можно считать, что с освоением технологии цианирования произошла наиболее крупная техническая революция в мировой золотодобывающей промышленности. Благодаря своим технологическим, экономическим, а также, как это ни странно звучит на первый взгляд, и экологическим преимуществам (см.бюлл. «Золотодобыча», вып. 112—114, 2008), цианистый процесс прочно занял ведущее место в промышленной практике производства золота из руд коренных месторождений, вытеснив из нее все остальные альтернативные гидрометаллургические варианты, включая и хлоринацию.
Уже к 1918 г. в мире не осталось ни одной действующей установки по хлоринационному выщелачиванию золота из руд или рудных концентратов.
В то же время в СССР и за рубежом продолжались интенсивные исследования по изучению теоретических и технологических аспектов гидрохлоринационного процесса с сопоставлением показателей этого процесса с цианированием золотосодержащих руд и концентратов. При этом установлен ряд преимуществ гидрохлорирования, позволявших с достаточной степенью оптимизма оценивать перспективы его использования в золотодобывающей промышленности. К ним отнесены /2/:
а) более высокая скорость выщелачивания золота хлорхлоридными растворами в связи с использованием больших концентраций окислителя (молекулярного хлора). Так, например, И.А.Каковский (1975) определил, что в сопоставимых условиях удельная скорость растворения золота при хлоринации в 13 раз выше, чем при цианировании с использованием кислорода, и в 43 (!) раза выше, чем при цианировании с продувкой воздуха.
б) возможность получения богатых по содержанию Au солянокислых растворов, из которых впоследствии удобно извлекать золото прямым электролизом.
в) эффективность применения хлоринационного выщелачивания золота к различным рудным материалам, трудно поддающимся цианированию, например, к сурьмянистым, мышьяковистым, медистым, теллуристым концентратам.
Однако, как показали соответствующие технологические разработки, перечисленные выше преимущества гидрохлорирования, тем не менее, не могут в полной мере компенсировать такие главные недостатки этого процесса, как необходимость использования агрессивных химических сред (соответственно — коррозионноустойчивых конструкционных материалов) и, особенно, высокий расход хлора в гидрометаллургическом цикле. Последнее обстоятельство вызвано тем, что в отличие от щелочных цианистых растворов (как правило, с очень низкой концентрацией растворителя — NaCN) кислые хлорсодержащие растворы обладают ярко выраженным коллективным растворяющим действием по отношению к большой группе минеральных компонентов, и, прежде всего, к сульфидам.
Отражением этого факта являются приведенные выше примеры промышленного использования хлоринации, когда обработке этим методом подвергали предварительно обожженные руды с минимальным содержанием сульфидной серы.
Кроме сульфидов, активными «потребителями» хлора являются карбонаты и оксиды щелочных металлов (CaO, MgO, и др.), сернокислые соли железа, тальк и другие химические соединения, присутствующие в исходном сырье или образующиеся в процессе окислительного обжига золотосодержащих руд (концентратов).
Наряду с высоким расходом хлора, при хлоринационном выщелачивании такого рода материалов происходит образование растворов с очень высоким солевым фоном, последующая химическая очистка которых вызывает гораздо более сложные проблемы по сравнению с очисткой циансодержащих хвостов и сточных вод.
По указанным выше причинам хлор пока не может рассматриваться как равноценный заменитель цианидов в гидрометаллургическом производстве золота (а также и серебра) из рудного сырья.
В настоящее время известны лишь отдельные, весьма немногочисленные примеры такого рода. Одним из них является хлоринационное выщелачивание золота из «шлакового» сурьмяного концентрата (огарок окислительного возгоночного обжига сурьмы) на в ЮАР /3/. По другой информации /2/ данный процесс применен при переработке руды, содержащей теллуриды золота, на предприятии «Эмперор Гоулд Майн» (Фиджи).
Вместе с тем открыты и получили соответствующее развитие возможности использования хлора в гидрометаллургии золота не в качестве заменителя цианидов, а как реагента в технологических операциях, дополняющих процесс цианирования. К таковым относятся:
— хлорное обезвреживание хвостов цианистого выщелачивания;
— применение хлора в целях нейтрализации сорбционноактивного углерода при цианировании технологически упорных углистых золотых руд и концентратов.
Способ детоксикации цианидов хлором является доминирующим в отечественной практике переработки золоторудного сырья и достаточно широко применяется за рубежом. По сравнению с другими альтернативными методами обезвреживания циансодержащих жидких отходов хлоринационный процесс обеспечивает наиболее полную очистку растворов как от цианидов (CN—), так и от тиоцианатов (CNS—). Существенный вклад в развитие и освоение хлоринационной технологии обезвреживания циансодержащих отходов и в изучение процессов природной деградации цианидов внесен специалистами созданной в 1967 г. в Иргиредмете лаборатории «Охраны окружающей среды».
Процесс химической пассивации сорбционноактивного углерода хлором перед цианированием углистых золотосодержащих руд разработан и реализован на нескольких предприятиях США в 70—80-х годах прошлого века. Наиболее интересными примерами промышленного использования такого варианта являются золотоизвлекательные фабрики «Джеррит Кэньон» и «Кэрлин».
На «Джеррит Кэньон» производят переработку двух типов руды: углистых (Au 8,5 г/т) и окисленных (5,8 г/т). Углистые руды характеризуются высоким содержанием углеорганического материала и пирита, с которым ассоциирована часть золота. Окисленные руды содержат меньшее количество органического углерода и больше карбонатных минералов: кальцита, доломита и др.
В 1983 г. на фабрике внедрена совместная переработка обоих типов руды. По принятой технологии углистая руда (сгущенный продукт измельчения с плотностью 53% твердого) подвергают окислению в атмосфере хлора. Процесс протекает в течение 16–20 ч при 70–80°С и небольшом избыточном давлении. Для нейтрализации образующейся при окислении пирита серной кислоты подается сода.
Хлорирование производят в герметических емкостях. Непрореагировавший хлор улавливают карбонатно-бикарбонатным раствором и возвращают в виде хлорной извести в процесс. Расход хлора составляет 12–23 кг на 1 т руды. После такой предварительной обработки пульпу направляют на цианирование, осуществляемое по методу CIL (сорбционное выщелачивание с гранулированным активированным углем), совместно с окисленной рудой. Сочетание процессов хлорного окисления и сорбционного цианирования обеспечивает извлечение золота из смеси руд (Au 6,7 г/т) на уровне 92%.
На фабрике «Кэрлин», в связи с вовлечением в эксплуатацию упорных углеродсодержащих руд, в 1974 г. запущена отдельная секция по их переработке (540 т в сутки). Руду (Au 5,5 г/т) подвергают хлорированию путем продувки пульпы газообразным хлором в течение 20 ч при 27–38°С. Чаны для хлоринации герметизированы и работают с повторным использованием выделяемого Сl2. С целью снижения расхода хлора (который первоначально достигал 200 кг на 1 т руды), на фабрике реализован процесс «факельного» хлорирования и, кроме того, осуществлена технология «двойного окисления». Суть технологии заключается в том, что руду в виде пульпы (40–50% твердого) первоначально обрабатывают воздухом в 4-х последовательно расположенных чанах, с добавкой соды (25 кг на 1 т твердого) при подогреве острым паром до 80°С. Полученную пульпу охлаждают до 50°С, после чего обрабатывают хлором последовательно в 6 чанах. Расход хлора при этом составляет примерно 25 кг на 1 т руды. Прохлорированная пульпа поступает на цианирование совместно с измельченной окисленной рудой. Извлечение золота в цианистом цикле из углистой руды — 86,9%, из окисленной руды — 88%, что свидетельствует о достаточно высокой степени подавления сорбционноактивного углерода в процессе «двойного окисления».
Имеются также другие примеры применения гидрохлорирования, о которых будет рассказано в дальнейшем.
ЛИТЕРАТУРА
1. Плаксин И.Н. Металлургия благородных металлов.-М.:Металлургиздат, 1943.-420 с.
2. Котляр Ю.А, Меретуков М.А., Стрижко Л.С. Металлургия благородных металлов: Учебник в 2-х кн.-М.: МИСИС, Издат.дом «Руда и металлы», 2005.-Кн.2.-392 с.
3. Лодейщиков В.В. Технология извлечения золота и серебра из упорных руд. В 2-х т.-Иркутск; Иргиредмет, 1999.-786 с.
Удобство метода и его недостатки
Бытовой способ проверки драгоценного металла на подлинность с применением йода:
Удобен и достаточно прост для использования.
Не требует сложных химических реагентов или специальной аппаратуры.
Может проводиться неспециалистами, достаточно внимательно наблюдать за реакцией взаимодействия двух элементов.
К недостаткам же придется отнести:
Проверку только поверхностной части украшений.
Невозможно со 100% ной точностью получить результат.
Нельзя проверить позолоченные изделия, верхний слой золота будет снят шкуркой.
Также возникают сложности с родированными изделиями, если снимается тонкий слой родия, из-под него проявляется желтоватый или красноватый металл.
Услуги ювелира как надежный и безопасный способ проверки подлинности металла
Народные методы тестирования металла хороши как экспресс-способ. Для надежности и уверенности в результатах стоит обратиться к профессиональному ювелиру. В его арсенале найдутся все необходимые средства выяснения подлинности золотого изделия.
У ювелира всегда под рукой необходимые инструменты для проверки драгоценных металлов.